original article:http://www.tulane.edu/~wiser/protozoology/notes/intes.html
INTESTINALE PROTOZOA
| Lumen-woningprotozoa |
|---|
Flagellaten:
Ameba:
Apicomplexa:
Microsporidia:
Andere:
|
Talrijke protozoa leven in het maagdarmkanaal van mensen (zie kader). Deze lijst bevat vertegenwoordigers van veel verschillende protozoaire groepen. De meeste van deze protozoa zijn niet-pathogene commensalen, of leiden slechts tot een milde ziekte. Sommige van deze organismen kunnen onder bepaalde omstandigheden ernstige ziekten veroorzaken. Bijvoorbeeld Giardia lamblia kan ernstige acute diarree die kan leiden tot chronische diarree en voedingsstoornissen veroorzaken; Entamoeba histolyticakan een zeer virulent en invasief organisme worden dat een potentieel dodelijke systemische ziekte veroorzaakt. Apicomplexa en microsporidia-soorten (elders besproken), die normaal gesproken geen ernstige ziekte oproepen, kunnen ernstige en levensbedreigende diarree veroorzaken bij aids-patiënten en andere immuungecompromitteerde individuen. Trichomonas vaginalis bevindt zich niet in het maagdarmkanaal, maar wordt vaak besproken met de darmflagellaten. Het infecteert het urogenitale kanaal en veroorzaakt een seksueel overdraagbare aandoening .
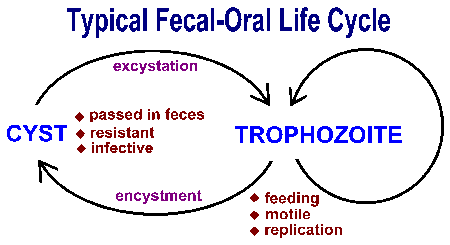
Intestinale protozoa worden overgedragen via de fecaal-orale route en vertonen de neiging vergelijkbare levenscycli te vertonen, bestaande uit een cyste stadium en een trofozoietstadium (figuur). Fecaal-orale overdracht omvat de inname van voedsel of water dat besmet is met cysten. Na opname door een geschikte gastheer transformeren de cysten in trofozoïeten die een actief metabolisme vertonen en meestal beweeglijk zijn. De parasiet neemt voedingsstoffen op en ondergaat aseksuele replicatie tijdens de trofische fase. Sommige trofozoïeten zullen zich ontwikkelen tot cysten in plaats van replicatie te ondergaan. Cysten worden gekenmerkt door een resistente wand en worden uitgescheiden met de ontlasting. De cystewand dient om het organisme te beschermen tegen uitdroging in de externe omgeving, aangezien de parasiet een relatief slapende periode doormaakt in afwachting van opname door de volgende gastheer.Factoren die de kans vergroten dat met fecaal materiaal besmet materiaal wordt opgenomen, spelen een rol bij de overdracht van deze darmprotozoa (zie kader). Over het algemeen bevorderen situaties met nauw mens-mens contact en onhygiënische omstandigheden de overdracht.
slechte persoonlijke hygiëne
ontwikkelingslanden
door water overgebrachte epidemieën
mannelijke homoseksualiteit
zoönose?
|
- Giardiasis
- Trichomoniasis
- Dientamoeba fragilis
- Balantidose
- Amebiasis
- Blastocystis hominis
- Niet-pathogene commensalen
GIARDIASIS
Giardia lamblia (ook bekend als G. duodenalis , zie opmerkingen over taxonomie ) is een protozoaire parasiet die de bovenste delen van de dunne darm koloniseert. Het heeft een wereldwijde distributie en is de meest voorkomende protozoa die wordt geïsoleerd uit menselijke ontlasting. De incidentie wordt geschat op 200 miljoen klinische gevallen per jaar. In feite was het waarschijnlijk de eerste symbiotische protozoa die ooit is waargenomen. Het is zeer aannemelijk dat Van Leeuwenhoek, de uitvinder van de microscoop, Giardia in 1681 voor het eerst beschreef in zijn eigen ontlasting op basis van zijn beschrijving van zijn karakteristieke beweging. Van Leeuwenhoek heeft echter nooit tekeningen van de organismen ingediend en Lambl krijgt meestal de eer voor de identificatie van Giardia in de ontlasting van pediatrische patiënten in Praque in 1859.
Giardia is doorgaans niet-invasief en leidt vaak tot asymptomatische infecties. Symptomatische Giardia wordt gekenmerkt door acute of chronische diarree en / of andere gastro-intestinale manifestaties.
LEVENSCYCLUS EN MORFOLOGIE
Giardia vertoont een typische fecaal-orale transmissiecyclus ( zie hierboven ). De infectie wordt opgelopen door het inslikken van cysten. Factoren die leiden tot besmetting van voedsel of water met fecaal materiaal, zijn gecorreleerd met transmissie (Box). Giardiasis komt bijvoorbeeld vooral voor bij kinderen en vooral bij kinderen in instellingen of kinderdagverblijven. In ontwikkelingslanden draagt slechte sanitaire voorzieningen bij tot de hogere niveaus van Giardiasis, en ook zijn er door water overgedragen uitbraken als gevolg van inadequate waterzuivering gedocumenteerd. Backpackers in gebieden zonder menselijke bewoning worden verondersteld te verwerven door te drinken uit beken en sommige gegevens suggereren dat bevers het reservoir zijn. De zoönotische overdracht van Giardiais controversieel en is niet ondubbelzinnig aangetoond. Het is niet duidelijk of Giardia lamblia een enkele soort vertegenwoordigt die in staat is om een breed scala aan dieren te infecteren, of dat elke gastheer zijn eigen ‘huisdier’ Giardia heeft . Er zijn aanwijzingen dat Giardia- overdracht tussen honden en mensen vrij zeldzaam is, in het voordeel van de laatste. Moleculair bewijs suggereert dat sommige isolaten een smal gastheertraject vertonen, terwijl andere een breed gastheertraject vertonen (zie opmerkingen over taxonomie ). Ongeacht of zoönotische overdracht mogelijk is, overdracht van persoon op persoon is de meest voorkomende overdrachtsmethode en de risicofactoren zijn nauw menselijk contact in combinatie met onhygiënische omstandigheden.
De ingenomen cyste gaat door de maag en het excystation vindt plaats in de twaalfvingerige darm. Excystation kan in vitro worden geïnduceerd door een korte blootstelling van de cysten aan zure pH (~ 2) of andere bronnen van waterstofionen. Deze blootstelling aan de zure pH bootst de toestand van de maag na en functioneert waarschijnlijk als een omgevingsfactor voor de parasiet. Flagellaire activiteit begint binnen 5-10 minuten na de zuurbehandeling en het trofozoiet komt tevoorschijn door een breuk in de cystewand. Aangenomen wordt dat de afbraak van de cystewand wordt gemedieerd door proteasen. Het trofozoiet zal cytokinese (celdeling zonder nucleaire replicatie) ondergaan binnen 30 minuten nadat het uit de cyste komt, wat resulteert in twee tweekernige trofozoïeten.
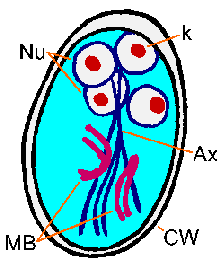
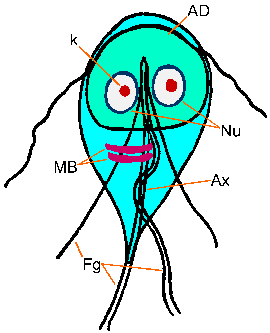 De Giardia- trofozoietvertoont een karakteristieke peer- of traanvorm met bilaterale symmetrie gezien vanaf de bovenkant (figuur). Het is typisch 12-15 µm lang, 5-10 µm breed en 2-4 µm dik. Karakteristieke kenmerken van het gekleurde trofozoiet zijn onder meer: twee kernen (Nu) met centrale karyosomen (k), fibrillen die over de lengte van de parasiet lopen en mediane lichamen (MB). Het grote karyosoom en het ontbreken van perifere chromatine geeft de kernen een halo-uiterlijk. De fibrillen worden axonemen (Ax) genoemd en worden gevormd uit de proximale gebieden van de flagella (Fg) in het lichaam van het trofozoiet. De middenlichamen zijn een paar gebogen staafvormige structuren die achter de kernen liggen. Op ultrastructureel niveau bevatten de mediane lichamen een reeks microtubuli. De functie van de middenlichamen is niet bekend,maar de meesten geloven dat ze op de een of andere manier betrokken zijn bij de kleefschijf en de vorming ervan. Een kleefschijf (AD), niet altijd zichtbaar met lichtmicroscopie, bezet de ventrale zijde van het voorste uiteinde.
De Giardia- trofozoietvertoont een karakteristieke peer- of traanvorm met bilaterale symmetrie gezien vanaf de bovenkant (figuur). Het is typisch 12-15 µm lang, 5-10 µm breed en 2-4 µm dik. Karakteristieke kenmerken van het gekleurde trofozoiet zijn onder meer: twee kernen (Nu) met centrale karyosomen (k), fibrillen die over de lengte van de parasiet lopen en mediane lichamen (MB). Het grote karyosoom en het ontbreken van perifere chromatine geeft de kernen een halo-uiterlijk. De fibrillen worden axonemen (Ax) genoemd en worden gevormd uit de proximale gebieden van de flagella (Fg) in het lichaam van het trofozoiet. De middenlichamen zijn een paar gebogen staafvormige structuren die achter de kernen liggen. Op ultrastructureel niveau bevatten de mediane lichamen een reeks microtubuli. De functie van de middenlichamen is niet bekend,maar de meesten geloven dat ze op de een of andere manier betrokken zijn bij de kleefschijf en de vorming ervan. Een kleefschijf (AD), niet altijd zichtbaar met lichtmicroscopie, bezet de ventrale zijde van het voorste uiteinde.
Giardia- trofozoïeten bezitten vier paar flagella en zijn beweeglijk. Drie paar flagellen komen uit het dorsale oppervlak (anterieur, posterieur-lateraal, caudaal) en één paar komt uit het ventrale oppervlak. Trofozoïeten vertonen een kenmerkende grillige draaiende beweging, soms vergeleken met die van een vallend blad. De trofozoïeten worden echter voornamelijk aangetroffen gehecht aan epitheelcellen van de dunne darm (vooral de twaalfvingerige darm en jejunum) en worden zelden aangetroffen in de ontlasting, behalve in gevallen van ernstige diarree. Deze aanhechting aan het darmepitheel wordt gemedieerd door een organel aan de ventrale zijde van de parasiet, de kleefschijf genoemd ( zie hieronder). Het trofozoiet absorbeert voedingsstoffen uit het darmlumen via pinocytose en er zijn geen gespecialiseerde voedingsorganellen beschreven.
Het trofische stadium wordt ook gekenmerkt door een aseksuele replicatie. Beide kernen delen zich ongeveer tegelijkertijd en cytokinese herstelt de binucleaire toestand. Elke dochtercel ontvangt een kopie van elke kernen. Beide kernen lijken gelijk met betrekking tot genexpressie en andere eigenschappen.
 Als alternatief voor replicatie kan het trophozoite encysten. Tijdens encystment rondt de parasiet zich af, maakt los van het darmepitheel en scheidt een cystewand af. Encystation kan ook in vitro worden uitgevoerd. Optimale inductie van encystment wordt verkregen door de trofozoïeten gal te onthouden bij pH 7, gevolgd door blootstelling aan hoge concentraties gal bij pH 7,8. Het gebrek aan gal bij neutrale pH bootst de omstandigheden na onder de slijmdeken naast de darmepitheelcellen, terwijl blootstelling aan hoge concentraties gal bij een meer basische pH analoog is aan het darmlumen. Deze onderzoeken benadrukken de mate waarin Giardia zich heeft aangepast aan het leven in het maagdarmkanaal.
Als alternatief voor replicatie kan het trophozoite encysten. Tijdens encystment rondt de parasiet zich af, maakt los van het darmepitheel en scheidt een cystewand af. Encystation kan ook in vitro worden uitgevoerd. Optimale inductie van encystment wordt verkregen door de trofozoïeten gal te onthouden bij pH 7, gevolgd door blootstelling aan hoge concentraties gal bij pH 7,8. Het gebrek aan gal bij neutrale pH bootst de omstandigheden na onder de slijmdeken naast de darmepitheelcellen, terwijl blootstelling aan hoge concentraties gal bij een meer basische pH analoog is aan het darmlumen. Deze onderzoeken benadrukken de mate waarin Giardia zich heeft aangepast aan het leven in het maagdarmkanaal.
Moleculaire en ultrastructurele studies onthullen de synthese van cyste-wandeiwitten en het verschijnen van grote secretoire blaasjes in het cytoplasma van de parasiet na de inductie van encystment. Na de vorming van een cystewand ondergaat de parasiet één ronde van nucleaire deling zonder cytokinese, resulterend in vier kernen. Deze vier kernen (Nu) bevinden zich meestal aan het voorste uiteinde van de cyste (figuur). De flagella en kleefschijf gaan verloren naarmate de cyste rijpt, maar de axonemen (Ax) en mediane lichamen (MB) blijven bestaan. De onderscheidende fibrillen (dwz axonemen), die zich over de lengte van de cyste uitstrekken, zorgen ervoor dat Giardia relatief gemakkelijk ondubbelzinnig te identificeren is. De cysten zijn ovaal van vorm en zijn typisch 11-14 µm lang en 6-10 µm breed. Andere kenmerken vanGiardia- cysten hebben een goed gedefinieerde wand (CW) die vaak losstaat van het cytoplasma van de parasiet. De cysten worden in de ontlasting doorgegeven en kunnen tot drie maanden overleven onder de juiste temperatuur- en vochtomstandigheden. Rijpe cysten zijn besmettelijk voor de volgende gastheer die ze toevallig opneemt, waardoor de levenscyclus wordt voltooid.
 |
 |
 |
 |
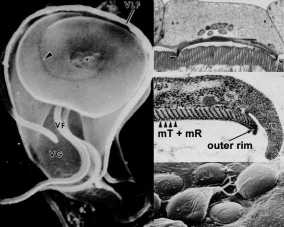
DE KLEEFSCHIJF
Een uniek ultrastructureel kenmerk van Giardia is de kleefschijf (ook wel ventrale schijf, zuigschijf, zuignap of gestreepte schijf genoemd). De kleefschijf heeft een concave structuur die ongeveer tweederde van het voorste uiteinde van het ventrale oppervlak beslaat (figuur, linkerpaneel). Zoals de namen impliceren, speelt deze structuur een rol bij de aanhechting van het trofozoiet aan het darmepitheel en ultrastructurele studies onthullen nauwe associaties tussen de kleefschijf en de darmborstelrand (figuur, paneel rechtsboven). ( Klik hier voor grotere afbeelding .)
Een belangrijk bestanddeel van microribbons zijn eiwitten die giardins worden genoemd (ook bekend als beta-giardins). Deze giardins spelen voornamelijk een structurele rol bij de vorming van de microribbons. Interessant is dat de Giardins een beperkte homologie vertonen met een eiwit genaamd ‘gestreepte vezelassemblin’ van Chlamydomonas (een vrijlevende, dubbelgevlagde eencellige alg). Bij Chlamydomonas vormt dit eiwit filamenteuze structuren aan de basis van de flagella. De Giardins zijn geëvolueerd om een andere functionele rol te spelen in Giardia , maar worden nog steeds geassocieerd met op microtubuli gebaseerde cytoskeletelementen.
Deze associatie van eiwitten die betrokken zijn bij het genereren van contractiekracht en andere cytoskeletelementen in de kleefschijf suggereert dat hechting wordt gemedieerd door mechanische krachten die door de parasiet worden gegenereerd. De waarneming dat afdrukken en cirkelvormige koepelvormige laesies achterblijven in de darmborstelgrens (dwz microvilli) na loslating van trofozoïeten (figuur, paneel rechtsonder) is consistent met contractiekrachten die een rol spelen bij hechting. Andere voorgestelde mechanismen voor de aanhechting van Giardiaaan het darmepitheel omvatten hydrodynamische krachten gegenereerd door de ventrale flagella en receptor-gemedieerde binding via lectines op het trofozoietoppervlak. De beweging van de flagella is echter slecht gecorreleerd met de hechting en de oppervlaktelectines bedekken het gehele trofozoiet en zijn niet specifiek gelokaliseerd op de kleefschijf.
 |
 |
 |
 |
SYMPTOMEN EN PATHOGENESE
De klinische kenmerken die verband houden met Giardia- infectie variëren van totale latentie (dwz asymptomatisch) tot acute zelfoplossende diarree, tot chronische syndromen geassocieerd met voedingsstoornissen, gewichtsverlies en groeiachterstand. Kinderen vertonen vaker klinische symptomen dan volwassenen en daaropvolgende infecties zijn doorgaans minder ernstig dan initiële infecties. De incubatietijd is over het algemeen 1-2 weken, maar er zijn bereiken van 1-75 dagen gerapporteerd.
De eerste tekenen van acute Giardia zijn misselijkheid, verminderde eetlust en een onbehaaglijk gevoel in het bovenste deel van het maagdarmkanaal. Deze symptomen worden vaak gevolgd of vergezeld van een plotseling begin van explosieve, waterige, stinkende diarree. Krukken geassocieerd met Giardiainfectie wordt over het algemeen omschreven als los, volumineus, schuimig en / of vet met afwezigheid van bloed of slijm, wat kan helpen om giardiasis te onderscheiden van andere acute diarree. Andere gastro-intestinale stoornissen die verband houden met giardiasis zijn onder meer: winderigheid, opgeblazen gevoel, anorexia, krampen en smerige zwavelhoudende boeren (soms ‘paarse burbs’ genoemd). De acute fase verdwijnt meestal spontaan binnen 3-4 dagen en wordt vaak niet herkend als Giardiasis. Af en toe zal een acute infectie echter aanhouden en leiden tot malabsorptie, steatorroe (overmatig vetverlies in de ontlasting), zwakte (krachtverlies) en gewichtsverlies. Sommige van de personen die de acute symptomen oplossen, maken de infectie niet duidelijk, maar worden asymptomatische cyste-passanten zonder klinische manifestaties,terwijl anderen een paar sporadische recidieven van de acute symptomen kunnen hebben.
Acute infecties kunnen zich ook ontwikkelen tot langdurige subacute of chronische infecties die in zeldzame gevallen jarenlang aanhouden. De typische patiënt in het chronische stadium presenteert zich met terugkerende korte periodes van losse vuile ontlasting die gelig, schuimig en zwevend kan zijn, vergezeld van intestinaal gorgelen, opgezette buik en winderigheid. Tussen afleveringen is de ontlasting meestal papperig, maar normale ontlasting of obstipatie kan ook voorkomen. Krampen komen niet vaak voor tijdens chronische infecties, maar zwavelhoudende boeren komen vaak voor. Anorexia, misselijkheid en epigastrische onbehagen zijn bijkomende veel voorkomende klachten bij chronische infecties. In de meeste chronische gevallen verdwijnen de parasieten en symptomen spontaan.
 |
| Klik voor grotere afbeelding |
De specifieke mechanismen van Giardiapathogenese die leidt tot diarree en intestinale malabsorptie worden niet volledig begrepen en er zijn geen specifieke virulentiefactoren geïdentificeerd. Bevestiging van trofozoïeten aan de borstelrand kan mechanische irritatie of slijmvliesletsel veroorzaken. Bovendien wordt bij sommige patiënten de normale villusstructuur aangetast. Zo zijn villus afstomping (atrofie) en cryptcelhypertrofie en een toename van de crypte-diepte in verschillende mate waargenomen. De toename van cryptcellen zal leiden tot een herbevolking van het darmepitheel door relatief onrijpe enterocyten met een verminderd absorptievermogen. Een verhoogde infiltratie van inflammatoire cellen in de lamina propria is ook waargenomen en deze ontsteking kan verband houden met de pathologie. Giardiainfectie kan ook leiden tot lactasedeficiëntie (zie lactose-intolerantie hieronder) en tot andere enzymdeficiënties in de microvilli. Deze verminderde vertering en opname van opgeloste stoffen kan leiden tot osmotische diarree en zou ook de malabsorptiesyndromen kunnen verklaren. Tot dusverre verklaart geen enkele virulentiefactor of verenigend mechanisme de pathogenese van Giardiasis. [Zie ook Pathofysiologie van diarree voor een algemene bespreking van diarree.]
Post- Giardia Lactose-intolerantie . Sommige patiënten kunnen een lactose-intolerentie vertonen tijdens actieve Giardia- infecties die kunnen aanhouden na verwijdering van de parasiet. Deze klinische manifestatie is te wijten aan de door parasieten geïnduceerde lactasedeficiëntie en komt het meest voor bij etnische groepen met een aanleg voor lactasedeficiëntie. Lactase is een enzym dat lactose, een suiker die in melk wordt aangetroffen, afbreekt tot monosacchariden die kunnen worden opgenomen. Dit lactose-intolerantiesyndroom moet worden overwogen bij personen die na de behandeling nog steeds slappe ontlasting en overmatig gas vertonen, maar geen detecteerbare parasieten hebben.
 |
 |
 |
 |
DIAGNOSE
|
Detectie van parasieten |
Krukonderzoek
Duodenale aspiratie of biopsie
|
De diagnose wordt bevestigd door het vinden van cysten of trofozoïeten in de ontlasting of in duodenojejunale aspiraten of biopsieën. Detectie van de parasieten kan moeilijk zijn, aangezien Giardia niet consistent in de ontlasting van alle patiënten voorkomt. Sommige patiënten zullen hoge cysteniveaus vertonen in bijna alle ontlasting, terwijl anderen slechts een laag aantal parasieten vertonen in sommige ontlasting. Er is ook een gemengd patroon waargenomen, waarin perioden van hoge uitscheiding van cysten worden afgewisseld met perioden van lage uitscheiding. Bovendien zijn parasieten bij acute infecties gemakkelijker te vinden dan bij chronische infecties. Aspiratie en biopsie kunnen de infectie ook niet bevestigen vanwege fragmentarische infectielocaties, en sommigen twijfelen aan het nut van deze invasieve procedures.
Ontlastingonderzoek is de voorkeursmethode voor de diagnose van Giardia . Drie keer ontlasting met tussenpozen van ten minste twee dagen moet worden onderzocht. Waterige of dunne ontlasting kan beweeglijke trofozoïeten bevatten die detecteerbaar zijn door onmiddellijk onderzoek van natte uitstrijkjes. Anders moet het monster worden bewaard en gekleurd vanwege de labiliteit van trofozoïeten. De sterkere cysten zijn relatief gemakkelijk te herkennen in directe of gekleurde uitstrijkjes ( zie cyste morfologie ). Daarnaast zijn er ook diagnostische kits op basis van immunofluorescentie of de detectie van copro-antigenen.
De diagnose kan ook worden gesteld door het duodenumvocht te onderzoeken op trofozoïeten. Duodenumvocht wordt verkregen door ofwel intubatie ofwel de Enterotest® (ook wel ‘stringtest’ genoemd). De Enterotest® bestaat uit een gelatinecapsule met daarin een nylondraad van de juiste lengte. Het vrije uiteinde van het koord wordt op het gezicht van de patiënt geplakt en de capsule wordt ingeslikt. Na vier uur tot een nacht wordt het koord teruggehaald en wordt het met gal bevlekte slijm op het distale deel van het koord eraf geschraapt en onderzocht door zowel natte montage als permanente kleuring. Een dunne darmbiopsie, bij voorkeur van meerdere duodenale en jejunale plaatsen, kan ook trofozoïeten onthullen die aan het darmepitheel zijn gehecht. [De dunne darm is verdeeld in 3 secties: de twaalfvingerige darm (eerste of proximale deel na de maag);het jejunum (het middelste deel); en het ileum (het distale of laatste deel voor de dikke darm).]
 |
 |
 |
 |
BEHANDELING EN CONTROLE
Geïnfecteerde personen moeten worden behandeld omdat Giardia kan aanhouden en kan leiden tot ernstige malabsorptiesyndromen en gewichtsverlies. De behandeling is effectief in het verminderen van morbiditeit en er zijn geen gevolgen. Metronidazol (Flagyl®), hoewel in de Verenigde Staten geen vergunning voor giardiasis, verwijdert effectief de parasiet (genezingspercentage ongeveer 85%) en is het favoriete medicijn. De aanbevolen dosering is 750 mg driemaal daags gedurende vijf dagen (of minimaal> 3 dagen). Voor kinderen wordt 15 mg / kg / dag in drie doses aanbevolen. Andere effectieve geneesmiddelen zijn: quinacrine (Atabrine®), tinidazol (Fasigyn®), furazolidon (Furoxone®) en paramomycine (Humatin®). Tinidazol is effectief als een enkele dosis van twee gram; paramomycine wordt niet geabsorbeerd en kan nuttig zijn tijdens de zwangerschap.
De wijdverspreide verspreiding van Giardia en de besmettelijkheid van de cysten maken het onwaarschijnlijk dat menselijke infectie volledig zal worden geëlimineerd. Beheersmaatregelen om Giardia- infectie te voorkomen of te verminderen zullen afhangen van de specifieke omstandigheden van overdracht, maar omvatten in het algemeen maatregelen die de opname van stoffen die zijn verontreinigd met fecaal materiaal voorkomen (zie fecaal-orale transmissiefactoren). Gezondheidsbevordering en -educatie die gericht zijn op het verbeteren van de persoonlijke hygiëne en waarbij de nadruk wordt gelegd op handen wassen, hygiëne en voedselverwerking, zijn effectieve controleactiviteiten om de overdracht van persoon op persoon te verminderen. Speciale aandacht voor persoonlijke hygiëne in risicovolle situaties zoals kinderdagverblijven en andere instellingen is nodig. Behandeling van asymptomatische leden van het huishouden voorkomt herinfectie in niet-endemische gebieden. De waarde van het behandelen van asymptomatische dragers in hyperendemische gemeenschappen is echter twijfelachtig, aangezien het aantal herinfecties hoog is. De sociaaleconomische situatie in veel ontwikkelingslanden maakt het moeilijk om infectie te voorkomen. Maatregelen op het gebied van de volksgezondheid om de watervoorziening tegen besmetting te beschermen zijn nodig om epidemieën te voorkomen en endemische effecten te verminderen.Toeristen mogen geen kraanwater drinken zonder aanvullende behandeling op plaatsen waar de zuiverheid twijfelachtig is. Koken of jodiumbehandeling is dodelijkGiardia- cysten, maar standaardchlorering niet. Er zijn geen veilige of effectieve chemoprofylatische geneesmiddelen voor Giardiasis.
 |
 |
 |
 |
TRICHOMONIASIS
- Tricomonad morfologie en soorten
- Transmissie en levenscyclus
- Symptomen en pathogenese
- Diagnose, behandeling en controle
De trichomonaden zijn een groep flagellated protozoa. De meeste leden van deze groep zijn parasitair en er zijn slechts enkele vrijlevende soorten geïdentificeerd. Over het algemeen zijn de trichomonaden niet-pathogene commensalen en zijn slechts enkele soorten van belang bij dieren en mensen. Vier soorten trichomonaden infecteren mensen (tabel). Van deze is alleen Trichomonas vaginalis duidelijk pathogeen en heeft het gewoonlijk een lage virulentie. De anderen vertonen een twijfelachtige pathogeniteit.
|
Trichomonaden van mensen |
||||||||||
|
De trichomonaden van mensen bewonen verschillende anatomische locaties. T. vaginalis is een veel voorkomende seksueel overdraagbare aandoening die wordt aangetroffen in het urogenitale kanaal. T. tenax, ook wel T. buccalis genoemd, is een commensaal van de menselijke mondholte en komt vooral voor bij patiënten met een slechte mondhygiëne en gevorderde parodontitis. T. tenax, of een organisme met een vergelijkbare morfologie, wordt ook af en toe in de longen aangetroffen. Dergelijke gevallen zijn voornamelijk gemeld bij patiënten met onderliggende kankers of andere longaandoeningen of na een operatie. Pentatrichomonas hominis , voorheen bekend als Trichomonas hominis , is een niet-pathogene commensaal van de dikke darm (zie niet-pathogene intestinale flagellaten). Sommige auteurs verdelen de trichomonaden in drie geslachten op basis van het aantal vrije flagellen. Soorten met drie flagellen worden Tritrichomonas genoemd , die met vier worden Trichomonas genoemd , en Pentatrichomonas verwijst naar trichomonaden met vijf gratis anterieure flagellen. Oorspronkelijk werd aangenomen dat Dientamoeba fragilis een ameba was (zie niet-pathogene intestinale ameba ). Nu is bekend dat het een flagellaat is – echter zonder flagella – verwant aan de trichomonaden.
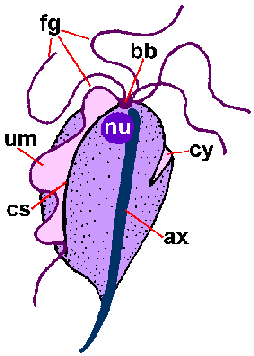
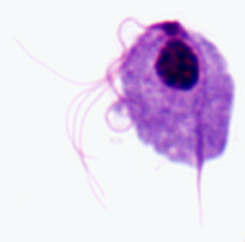
Een onderscheidend kenmerk van de trichomonaden is een axostyle (bijl) die over de lengte van het organisme loopt en lijkt uit te steken vanaf het achterste uiteinde (figuur). De axostyle is een cytoskeletelement dat bestaat uit concentrische rijen microtubuli en wordt verondersteld te functioneren bij de hechting van de parasiet aan epitheelcellen. Trichomonaden worden ook gekenmerkt door 4-6 flagella (fg) die uit het voorste uiteinde komen. Een van de flagellen zit vast aan het lichaam van het organisme en vormt een naar achteren gericht golvend membraan (um), terwijl de overige flagellen vrij zijn. De gecombineerde basale lichamen (bb) en de basis van het golvende membraan, de costa (cs) genoemd, worden vaak gezien als gekleurde preparaten. Minder vaak gezien is de cytostomale groef (cy). Een enkele kern (nu) wordt gevonden aan het voorste uiteinde van de parasiet.
 |
 |
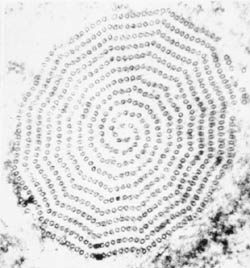 |
| Schematische weergave van de belangrijkste structurele kenmerken van trichmonaden (links). Giemsa-gekleurde trofozoiet van T. vaginalis uit in vitro kweek (midden). Elektronenmicrofoto van axostyle dwarsdoorsnede met concentrische rijen microtubuli (rechts). | ||
De trichomonaden vertonen, net als veel andere intestinale protozoa, een aneroob metabolisme en missen mitochondriën. Een deel van het energiemetabolisme van trichomonaden omvat een uniek organel dat het hydrogenosoom wordt genoemd. Het hydrogenosoom heeft een dubbel membraan en is in de verte verwant aan het mitochondrion. Het mist echter DNA, cytochromen en veel typische mitochnondriale functies zoals enzymen van de tricarbonzuurcyclus en oxidatieve fosforylering. De primaire functie van het hydrogenosoom is het metabolisme van pyruvaat, geproduceerd tijdens glycolyse in het cytosol, tot acetaat en kooldioxide met de gelijktijdige productie van ATP. De elektronen die vrijkomen bij de oxidatie van pyruvaat worden overgebracht naar waterstofionen om moleculaire waterstof te produceren, vandaar de naam hydrogenosoom.
 |
 |
 |
 |
TRICHOMONAS VAGINALIS
Trichomonas vaginalis werd voor het eerst beschreven als gevolg van etterende vaginale afscheiding in 1836 en werd in het begin van de twintigste eeuw erkend als een etiologisch agens van vaginitis. Trichomoniasis is een veel voorkomende seksueel overdraagbare aandoening met een wereldwijde verspreiding en naar schatting raken 167 miljoen mensen per jaar wereldwijd besmet en 5 miljoen nieuwe infecties per jaar in de Verenigde Staten. Trichomoniasis wordt beschouwd als de meest voorkomende niet-virale seksueel overdraagbare aandoening. Ondanks de frequentie van trichomoniasis werd het in het verleden eerder als een hinderlijke parasiet beschouwd dan als een belangrijke ziekteverwekker. Het wordt nu echter erkend als een factor die de hiv-infectie bevordert (zie kader), waardoor het veroorzaakt vroeggeboorten met een laag gewicht en vrouwen vatbaar maakt voor aanzienlijk ongemak en stress.
|
Trichomonas en HIV |
De pathologie die door Trichomonas wordt veroorzaakt, kan de efficiëntie van de overdracht van hiv verbeteren (1). T. vaginalis- infectie wekt typisch een lokale cellulaire immuunrespons op met ontsteking van het vaginale epitheel en de baarmoederhals bij vrouwen en de urethra van mannen. Deze ontstekingsreactie omvat de infiltratie van potentiële HIV-doelwitcellen zoals CD4 + -dragende lymfocyten en macrofagen. Bovendien T. vaginaliskan bloedingen punctata op de vaginale wanden en baarmoederhals veroorzaken. Deze infiltratie van leukocyten en de genitale laesies kunnen het aantal doelcellen voor het virus verhogen en directe virale toegang tot de bloedbaan mogelijk maken via open laesies. Bovendien kunnen de bloedingen en ontstekingen het virusgehalte in lichaamsvloeistoffen verhogen en het aantal met HIV geïnfecteerde lymfocyten en macrofagen in het genitale gebied verhogen bij personen die al met HIV zijn geïnfecteerd. Deze toename van gratis virussen en met virus geïnfecteerde leukocyten kan de kans op hiv-blootstelling en overdracht op een niet-geïnfecteerde partner vergroten. Er is aangetoond dat verhoogde cervicale uitscheiding van HIV gepaard gaat met baarmoederhalsontsteking,en substantieel verhoogde virale ladingen in sperma zijn gedocumenteerd bij mannen met trichomoniasis. Bovendien aangezien veel patiënten metTrichomonas- infectie is asymptomatisch, of slechts licht symptomatisch, ze blijven waarschijnlijk seksueel actief ondanks infectie.
|
T. vaginalis infecteert, ondanks zijn naam, zowel mannen als vrouwen. Bij vrouwen leeft het organisme voornamelijk in de vagina, en bij mannen wordt het meestal aangetroffen in de urethra, prostaat of bijbal. De levenscyclus bestaat alleen uit een trofozoietstadium dat wordt overgedragen door direct contact tijdens geslachtsgemeenschap. Niet-venerische overdracht is zeldzaam, maar mogelijk omdat de trofozoïeten 1-2 dagen in de urine en 2-3 uur op een natte spons kunnen overleven. Bovendien zijn neonatalen geïnfecteerd tijdens het geboorteproces. De trofozoïeten leven nauw verbonden met of gehecht aan het epitheel van het urogenitale kanaal, waar ze repliceren door binaire splitsing.
 |
 |
 |
 |
SYMPTOMEN EN PATHOGENESE
|
Klinische verschijnselen |
|
|
Vrouwtjes |
Mannetjes |
|
|
| *% geïnfecteerd; **% symptomatisch | |
T. vaginalis veroorzaakt verschillende klinische manifestaties bij mannen en vrouwen en vrouwen (tabel) vertonen vaker symptomen die meestal langer aanhouden. De incubatietijd varieert doorgaans van 4 tot 28 dagen. Bij vrouwen kan de infectie zich voordoen als een milde vaginitis, een acute of chronische vulvovaginitis of urethritis. Het optreden of verergeren van symptomen treedt vaak op tijdens of onmiddellijk na de menstratie. De meest voorkomende klacht bij T. vaginalisinfectie is een aanhoudende milde vaginitis die gepaard gaat met een overvloedige, stinkende afscheiding die vaak gepaard gaat met branderigheid of jeuk. Deze afscheiding is meestal grijs, maar kan geel of groen zijn en is af en toe schuimig of bloedig. De afscheiding neemt af naarmate de infectie chronischer wordt. Veel vrouwen ervaren ook pijnlijke of moeilijke coïtus. Betrokkenheid van de urethra komt in een groot aantal gevallen voor en wordt gekenmerkt door dysurie (pijnlijk urineren) en frequent urineren.
Het vaginale epitheel is de belangrijkste infectieplaats. De vaginale wanden zijn dus meestal erythemateus (dwz rood) en kunnen petechiale (een kleine niet-verheven vlek) bloedingen vertonen. Puntige bloedingen van de baarmoederhals, de cervix van aardbeien genoemd, worden in ongeveer 2% van de gevallen waargenomen. Deze aardbei-baarmoederhals is een kenmerkende pathologische observatie die verband houdt met trichomonase en die niet wordt gezien bij andere seksueel overdraagbare aandoeningen.
Mannetjes zijn waarschijnlijk asymptomatisch (50-90%) en de infectie heeft de neiging zichzelf te beperken. De urethra en prostaat zijn de meest voorkomende infectieplaatsen. Veel voorkomende symptomen zijn: urethrale afscheiding (variërend van karig tot etterig), dysurie en urethrale pruritus (jeuk). Sommige mannen ervaren een branderig gevoel onmiddellijk na de coïtus.
Er is weinig bekend over de pathofysiologie geassocieerd met T. vaginalis- infectie, maar wordt vermoedelijk veroorzaakt door interacties tussen de parasiet en gastheerepitheelcellen. In vitro studies tonen aan dat T. vaginalis cellen op een contactafhankelijke manier kan vernietigen. Daarom wordt aangenomen dat adhesie van de trofozoïeten aan het epitheel een belangrijke factor is bij de pathogenese. Verschillende adhesie-eiwitten zijn geïdentificeerd op het oppervlak van de trofozoïeten. Bovendien zijn ook uitgescheiden proteasen geïdentificeerd die een rol zouden kunnen spelen bij pathogenese.
 |
 |
 |
 |
DIAGNOSE, BEHANDELING EN CONTROLE
Over het algemeen zijn de klinische manifestaties niet betrouwbaar als enige diagnosemiddel, aangezien de klinische presentatie vergelijkbaar is met andere SOA’s en veel patiënten milde of geen symptomen hebben. De diagnose wordt bevestigd door het aantonen van trofozoïeten in vaginale, urethrale, prostaatafscheidingen of urinesediment (na prostaatmassage). Microscopisch onderzoek van natte bergingen van verse vaginale afscheiding, bij voorkeur verzameld met een speculum op een wattenstaafje, is de meest praktische diagnosemethode. Monsters moeten worden verdund in zoutoplossing en onmiddellijk worden onderzocht. T. vaginalis wordt herkend aan zijn karakteristieke morfologische kenmerken ( zie hierboven) en zijn snelle schokkerige beweeglijkheid. Specimens kunnen ook worden gefixeerd en gekleurd met Giemsa of fluorescerende kleurstoffen. Het organisme kan echter moeilijk te herkennen zijn op gekleurde objectglaasjes.
De gevoeligheid van directe observatie varieert van 40-80%. Daarom wordt in vitro kweek ondanks enkele beperkingen beschouwd als de gouden standaard voor diagnose. Toegang tot faciliteiten is bijvoorbeeld nodig en organismen hebben 2-7 dagen groei nodig voordat ze worden gedetecteerd. Het toegankelijkheidsprobleem wordt gedeeltelijk opgelost door het InPouch ™ TV-kweeksysteem (Biomed Diagnostics). Dit is een in de handel verkrijgbaar op zichzelf staand systeem voor de detectie van T. vaginalis in klinische specimens. Op antilichamen en DNA gebaseerde tests met hoge gevoeligheid en specificiteit worden ontwikkeld.
Metronidazol (Flagyl®) en andere nitroimidazolen, zoals tinidazol, zijn zeer effectief tegen trichomoniasis. De metronidazol wordt geactiveerd door het waterstofatoom tot een nitroradicaal-iontussenproduct. Ofwel een enkele dosis van twee gram (85-92% genezingspercentage) of 250 mg driemaal daags gedurende 7-10 dagen (> 95% genezingspercentage) kan worden gebruikt. Seksuele partners moeten tegelijkertijd worden behandeld om herinfectie te voorkomen. Er is enige resistentie tegen geneesmiddelen gemeld, maar dit is geen wijdverbreid probleem. Het mislukken van de behandeling is over het algemeen te wijten aan niet-naleving of herinfectie.
|
Trichomoniasis als SOA |
|
De epidemiologie van trichomonase vertoont kenmerken die vergelijkbaar zijn met andere seksueel overdraagbare aandoeningen (Box) en de incidentie correleert met het aantal seksuele partners. Bovendien komt gelijktijdige infectie met andere SOA’s vaak voor. Geschat wordt dat tot 25% van de seksueel actieve vrouwen op enig moment in hun leven besmet zal raken en de ziekte zal worden overgedragen op 30-70% van hun mannelijke partners. Maatregelen die worden gebruikt bij de bestrijding van andere SOA, zoals het beperken van het aantal seksuele partners en het gebruik van condooms, zijn ook effectief bij het voorkomen van trichomoniasis.
Beoordelingen over Trichomoniasis:
- Lehker, MW en Alderete, JF (2000) Biologie van trichomonose. Huidige mening over infectieziekten 13, 37-45 .
- Petrin, D., Delgaty, K., Bhatt, R., Garber, G. (1998) Klinische en microbiologische aspecten van Trichomonas vaginalis . Clin. Microbiol. Openbaring 11: 300-317 .
- Schwebke, JR en Burgess, D. (2004) Trichomoniasis. Clinical Microbiology Reviews 17, 794-803 .
 |
 |
 |
 |
DIENTAMOEBA FRAGILIS
Dientamoeba fragilis werd oorspronkelijk beschreven als een ameba op basis van zijn morfologie. Later werd echter erkend dat het een morfologie vertoonde die meer leek op de kalkoenparasiet Histomonas meleagridis , met uitzondering van het ontbreken van flagella. Ultrastructurele studies suggereren ook overeenkomsten met de trichomonaden, waaronder het bezit van hydrogenosomen, en moleculaire studies hebben een nauwe fylogenetische relatie tussen Dientamoeba en Histomonas en een mogelijk meer distale relatie met Trichomonas bevestigd .
Net als bij andere trichomonaden, vertoont Dientamoeba alleen een trofozoietstadium (figuur). Dit roept enkele vragen op over de wijze van overdracht, aangezien een cyste stadium gewoonlijk betrokken is bij fecale orale overdracht. Bovendien overleven de trofozoïeten van Dientamoeba gedurende een zeer korte tijd buiten het lichaam. H. meleagridis heeft ook geen cyste stadium en er is aangetoond dat het wordt overgedragen via de eieren van een nematode. Vanwege de nauwe relatie tussen Histomonas en Dientamoeba , wordt voorgesteld dat Dientamoeba ook wordt overgedragen via wormeieren. Epidemiologisch en experimenteel bewijs neigt ertoe de pinworm te beschuldigenEnterobius vermicularis als drager voor Dientamoeba . Meer recentelijk is aangetoond dat varkens een natuurlijke gastheer zijn voor D. fragilis van hetzelfde genotype als bij mensen, waardoor de mogelijkheid van een zoönotische overdracht groter wordt ( Cacciò et al, Emerg Infect Dis 18 (5): 838-841, 2012 ).
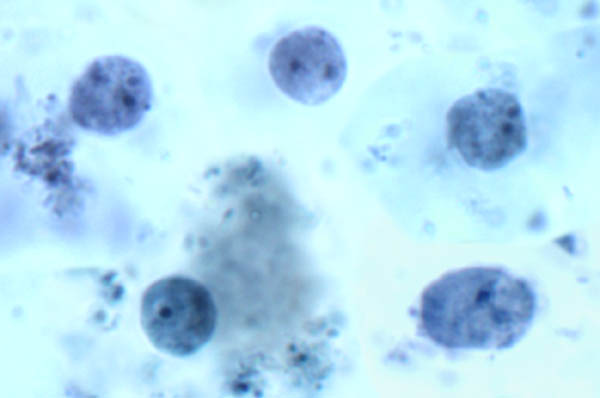 |
| Morfologie van Dientamoeba fragilis uit een ontlastingsmonster. Trofozoïeten vertonen een amebeachtige morfologie en hebben vaak een dubbele kern. |
Historisch gezien werd Dientamoeba beschouwd als een niet-pathogene commensaal. Klinische symptomen correleren echter vaak met de aanwezigheid van grote aantallen trofozoïeten en behandeling van de infectie lost de symptomen op. De incidentie van symptomen wordt geschat op 15-30% van de geïnfecteerde personen. Klinische symptomen geassocieerd met Dientamoeba zijn onder meer intermitterende diarree, buikpijn, winderigheid, misselijkheid en vermoeidheid. Er is weinig bekend over de pathogenese en Dientamoeba werkt waarschijnlijk als een laaggradig irriterend middel van intestinale slijmvliesoppervlakken die tot enige ontsteking kunnen leiden. Iodoquinol is over het algemeen het voorkeursgeneesmiddel voor de behandeling van Dientamoeba . Paromomycine en metronidazol zijn ook effectief.
Recensies over Dientamoeba
- Johnson et al (2004) Uit de vergetelheid komen: biologische, klinische en diagnostische aspecten van Dientamoeba fragilis. Clin Microbiol Rev 17: 553 .
- Barratt JL et al (2011) Een overzicht van het dragerschap van Dientamoeba fragilis bij mensen: verschillende redenen waarom dit organisme in aanmerking moet worden genomen bij de diagnose van gastro-intestinale aandoeningen. Gut Microbes 2: 3-12 .
 |
 |
 |
 |
BALANTIDOSE
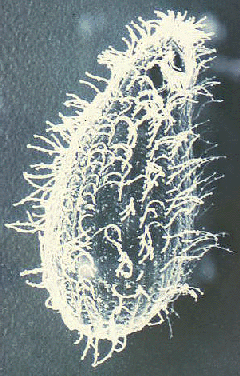 Balantidium coli is het enige ciliaat dat mensen infecteert. Het komt wereldwijd voor, maar net als veel andere fecaal-orale overdraagbare aandoeningen, komt het vaker voor in de tropen. De prevalentiecijfers bedragen echter zelden meer dan 1%. B. coliinfecteert ook een grote verscheidenheid aan zoogdieren en komt vooral veel voor bij apen en varkens. De prevalentie bij varkens varieert van 20-100% en menselijke balantidiose vertoont gewoonlijk een verhoogde prevalentie in gemeenschappen die nauw samenleven met varkens. In Papoea-Nieuw-Guinea, waar varkens de belangrijkste huisdieren zijn, is de prevalentie onder varkenshoeders en slachthuispersoneel bijvoorbeeld maar liefst 28%. Overdracht van mens op mens is ook gedocumenteerd en deze wijze van overdracht zal waarschijnlijk plaatsvinden in omgevingen met drukte en slechte persoonlijke hygiëne, zoals psychiatrische ziekenhuizen en gevangenissen. ( Sla algemene ciliaatbiologie over )
Balantidium coli is het enige ciliaat dat mensen infecteert. Het komt wereldwijd voor, maar net als veel andere fecaal-orale overdraagbare aandoeningen, komt het vaker voor in de tropen. De prevalentiecijfers bedragen echter zelden meer dan 1%. B. coliinfecteert ook een grote verscheidenheid aan zoogdieren en komt vooral veel voor bij apen en varkens. De prevalentie bij varkens varieert van 20-100% en menselijke balantidiose vertoont gewoonlijk een verhoogde prevalentie in gemeenschappen die nauw samenleven met varkens. In Papoea-Nieuw-Guinea, waar varkens de belangrijkste huisdieren zijn, is de prevalentie onder varkenshoeders en slachthuispersoneel bijvoorbeeld maar liefst 28%. Overdracht van mens op mens is ook gedocumenteerd en deze wijze van overdracht zal waarschijnlijk plaatsvinden in omgevingen met drukte en slechte persoonlijke hygiëne, zoals psychiatrische ziekenhuizen en gevangenissen. ( Sla algemene ciliaatbiologie over )
ALGEMENE CILIATE BIOLOGIE
Ciliaten zijn een grote en diverse groep protozoa. De meeste ciliaten leven vrij en zijn te vinden in verschillende habitats. Bekende ciliaten zijn onder meer Paramecium- soorten, die in vijvers over de hele wereld voorkomen, en Ichthyophthirius multifiliis, een ectoparasiet van vis die witte vlekziekte veroorzaakt (ook wel ‘ick’ genoemd). Zoals de naam al aangeeft, bezitten ciliaten op een bepaald moment tijdens hun levenscyclus cilia. De trilharen zijn over het algemeen gerangschikt in longitudinale rijen en bedekken typisch het oppervlak van het organisme. Ciliaten worden ook gekenmerkt door nucleair dimorfisme doordat ze twee verschillende kernen hebben. De grote niervormige macronucleus is betrokken bij de ‘huishouding’ of somatische functies van de cel, terwijl de kleinere bolvormige micronucleus het volledige genoom bevat. De macronucleus bevat duizenden kopieën van transcriptioneel actieve ‘minichromosomen’ die 10-20.000 verschillende DNA-moleculen vertegenwoordigen.Dit grote aantal telomeren (chromosoomuiteinden) resulteerde in ciliaten als een vroeg modelsysteem voor de studie van telomeren en telomerase (het enzym dat telomeren synthetiseert).
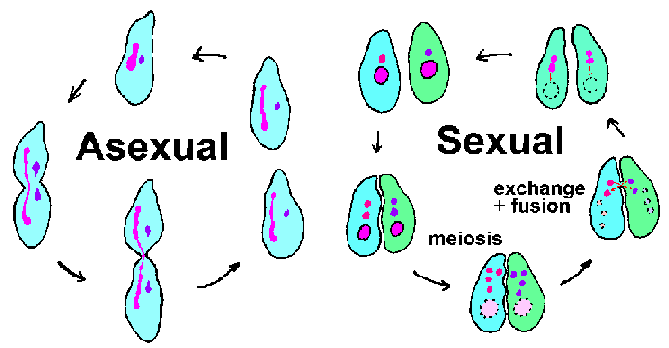
Ciliaten ondergaan zowel een aseksuele voortplanting (dwz binaire splitsing) als een seksuele voortplanting met vervoeging (figuur hierboven). Tijdens de vervoeging paren twee ciliaten van tegenovergestelde paringstypen en wisselen genetisch materiaal uit. Echtelijk contact triggert meiose in de micronuclei, wat resulteert in 4 haploïde micronuclei. Tegelijkertijd breekt de macronucleus af en verdwijnt. Drie van de micronuclei vallen uiteen en de resterende micronucleus deelt zich weer. Elk van de conjugerende organismen schenkt een micronucleus (gametisch of mannelijk) aan zijn partner via een cytoplasmatische brug die hen verbindt. De gametische micronucleus versmelt met de stationaire (of vrouwelijke) micronucleus en vormt de diploïde zygotische micronucleus. Het conjucerende paar scheidt zich en de zygotische nucluei ondergaan nog een delingsronde.Een van deze micronuclei ontwikkelt zich tot de macronucleus en voltooit daarmee de cyclus. De vorming van de macronucleus omvat fragmentatie van de chromosomen en verlies van DNA-sequenties die overeenkomen met genen die niet op hoge niveaus tot expressie worden gebracht tijdens de normale aseksuele cyclus. De resterende DNA-fragmenten, of minichromosomen, worden vervolgens geamplificeerd. (Zie diagram van DNA-verwerking tijdens macronucleusvorming.)
 BALANTIDOSE
BALANTIDOSE
B. coli leeft gewoonlijk als een niet-pathogene commensaal in de dikke darm en veroorzaakt geen symptomen. Er kan oppervlakkige ontsteking van het darmslijmvlies optreden, wat kan leiden tot diarree en koliekpijn. Milde of chronische infecties worden gekenmerkt door intermitterende diarree en obstipatie, gewichtsverlies en buikpijn. In zeldzame gevallen zullen de trofozoïeten het darmepitheel binnendringen en ulceratie veroorzaken. Klinisch resulteert dit in een acute diarree met slijm en bloed (dwz dysenterie). Deze balantidiale dysenterie is vergelijkbaar met de dysenterie die wordt geproduceerd door Entameoba histolytica ( zie hieronder). Zeldzame extra-intestinale infecties van longen, vagina, urineleider en urineblaas en darmperforaties die tot peritonitis hebben geleid, zijn gemeld.
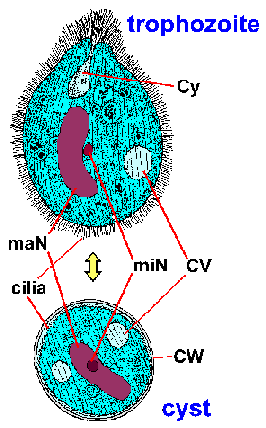
De laboratoriumdiagnose wordt gesteld door het organisme in de ontlasting te identificeren. Balantidium vertoont een typische fecaal-orale levenscyclus bestaande uit trofozoiet- en cyste-stadia. De grote omvang en unieke morfologische kenmerken van Balantidium(Figuur) sluit de verwarring uit met andere protozoa die in menselijke uitwerpselen worden aangetroffen. Het trophozoite is eivormig en heeft een gemiddelde grootte van 70 x 45 µm, maar kan oplopen tot 150-200 µm. De cyste heeft een kenmerkende cystewand (CW) en is meer bolvormig met een gemiddelde diameter van 55 µm. Bij gekleurde specimens is de meest voor de hand liggende interne structuur de grote macronucleus (maN). De micronucleus (miN) is misschien niet altijd duidelijk vanwege de nauwe associatie met de macronucleus. Contractiele vacuolen (CV), die functioneren in osmotische regulatie, zijn vaak zichtbaar en soms is het cytostoom (Cy) detecteerbaar. Net als veel andere ciliaten, wordt Balantidium bedekt door rijen trilharen. De trilharen geven het oppervlak van de parasiet een wazig uiterlijk en zijn minder uitgesproken in het cyste stadium.
De voorkeursbehandeling is tetracycline dat gedurende 10 dagen viermaal daags 500 mg wordt gegeven. Iodoquinol is het aanbevolen alternatieve medicijn. Metronidazol heeft geen consistente resultaten opgeleverd. Preventieve maatregelen zijn hetzelfde als andere ziekten die worden overgedragen via de fecaal-orale route (zie fecaal-orale transmissiefactoren of bespreking van Giardia- preventie ). Bovendien moet de riolering van varkens uit de buurt worden gehouden van drinkwater en voedsel.
 |
 |
 |
 |
AMEBIASIS
Verschillende leden van het geslacht Entamoeba infecteren mensen (zie hieronder). Onder deze wordt alleen E. histolytica als pathogeen beschouwd en de ziekte die het veroorzaakt, wordt amebiasis of amebische dysenterie genoemd. E. dispar is morfologisch identiek aan E. histolytica en de twee werden voorheen als dezelfde soort beschouwd. Genetische en biochemische gegevens geven echter aan dat de niet-pathogene E. histolytica een aparte soort is ( zie bespreking van criteria). De twee soorten komen over de hele wereld voor, maar net als veel andere darmprotozoa komen ze vaker voor in tropische landen of andere gebieden met slechte hygiënische omstandigheden. Geschat wordt dat tot 10% van de wereldbevolking besmet kan zijn met E. histolytica of E. dispar en in veel tropische landen kan de prevalentie de 50% benaderen. Er zijn naar schatting 50 miljoen gevallen van amebiasis per jaar en tot 100.000 doden.
- Levenscyclus en morfologie
- Pathogenese
- Mogelijke mechanismen van pathogenese
- Klinische presentatie
- Diagnose, behandeling en controle
 |
 |
 |
 |
LEVENSCYCLUS EN MORFOLOGIE
E. histolytica vertoont een typische fecaal-orale levenscyclus die bestaat uit infectieuze cysten die in de ontlasting worden doorgegeven en trofozoïeten die repliceren in de dikke darm. De infectie wordt opgelopen door het inslikken van cysten en de risicofactoren zijn vergelijkbaar met andere ziekten die via de fecaal-orale route worden overgedragen ( zie tabel ). Besmet voedsel en water zijn waarschijnlijk de belangrijkste infectiebronnen. De hogere prevalentie in gebieden met een lagere sociaaleconomische status is waarschijnlijk te wijten aan slechte sanitaire voorzieningen en een gebrek aan sanitair binnenshuis. Echter, E. histolytica is zelden de oorzaak van de reizigers diarree en wordt meestal geassocieerd met een langdurige (> 1 maand) verblijf in een endemisch gebied. Een hogere prevalentie van E. histolyticainfectie wordt ook waargenomen in instellingen, zoals psychiatrische ziekenhuizen, weeshuizen en gevangenissen, waar verdringing en problemen met fecale besmetting hieraan bijdragen. Er is ook een hoge prevalentie onder mannelijke homoseksuelen vastgesteld. Mensen zijn de enige gastheer van E. histolytica en er zijn geen dierlijke reservoirs.
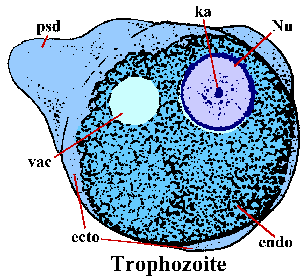 Bij inname passeren de cysten de maag en excyste in het onderste deel van de dunne darm. Excystation omvat een verstoring van de cystewand en de vierkernige ameba komt door de opening naar buiten. De amebe ondergaat nog een ronde van nucleaire deling, gevolgd door drie opeenvolgende cycli van cytokinese (dwz celdeling) om acht kleine niet-kernige trofozoïeten te produceren, soms amebulae genoemd. Deze onrijpe trofozoïeten koloniseren de dikke darm, vooral de cecale en sigmoïdorectale gebieden, waar ze zich voeden met bacteriën en celresten en herhaalde rondes van binaire splitsing ondergaan.
Bij inname passeren de cysten de maag en excyste in het onderste deel van de dunne darm. Excystation omvat een verstoring van de cystewand en de vierkernige ameba komt door de opening naar buiten. De amebe ondergaat nog een ronde van nucleaire deling, gevolgd door drie opeenvolgende cycli van cytokinese (dwz celdeling) om acht kleine niet-kernige trofozoïeten te produceren, soms amebulae genoemd. Deze onrijpe trofozoïeten koloniseren de dikke darm, vooral de cecale en sigmoïdorectale gebieden, waar ze zich voeden met bacteriën en celresten en herhaalde rondes van binaire splitsing ondergaan.
E. histolytica trofozoïeten hebben een amorfe vorm en hebben over het algemeen een diameter van 15-30 µm. De trofozoïeten bewegen door een vingervormig pseudopodium (psd) uit te strekken en de rest van het lichaam naar voren te trekken (ameboïde beweging genoemd). De pseudopodia, en soms de buitenrand van het trofozoiet, hebben een duidelijk refractiel uiterlijk en worden het ectoplasma (ecto) genoemd. De rest van het cytoplasma heeft een korrelig uiterlijk en wordt het endoplasma (endo) genoemd. Af en toe is een glycogeenvacuole (vac) duidelijk. Nucleaire (Nu) morfologie in gekleurde specimens wordt gekenmerkt door een fijnkorrelige ring van perifere chromatine en een centraal gelegen karyosoom (ka).
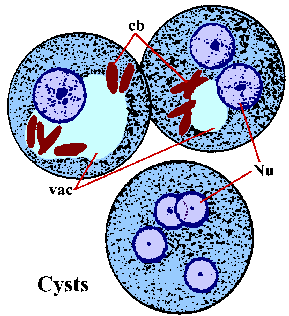 Als alternatief voor aseksuele replicatie kunnen trofozoïeten ook encysten. De factoren die verantwoordelijk zijn voor de inductie van encystation zijn niet bekend. Encystation begint met de trofozoïeten die meer bolvormig worden en het verschijnen van chromatoïde lichamen in het cytoplasma. Chromatoïde lichamen (cb) zijn gekleurde langwerpige structuren met ronde uiteinden en vertegenwoordigen de aggregatie van ribosomen. De cystewand is samengesteld uit chitine en heeft een glad, refractiel uiterlijk. Cyste rijping omvat twee ronden van nucleaire replicatie zonder celdeling en cysten met 1-4 kernen (Nu) worden gevonden in de ontlasting. De nucleaire morfologie van de cyste is vergelijkbaar met die van de trofozoiet, behalve dat de kernen steeds kleiner worden na elke deling. Soms zijn de jonge cysten (bijv.1-2 kernen) hebben een glycogeen vacuole (vac) die zal verschijnen als een helder gebied in gekleurde monsters. Deze vacuole zal soms de morfologie van de kernen verplaatsen en veranderen. De chromatoïde lichamen hebben de neiging te verdwijnen als de cyste rijpt. De cysten hebben over het algemeen een diameter van 12-15 µm. Cysten zijn onmiddellijk besmettelijk bij uitscheiding met de ontlasting en zullen weken tot maanden levensvatbaar zijn, afhankelijk van de omgevingsomstandigheden.
Als alternatief voor aseksuele replicatie kunnen trofozoïeten ook encysten. De factoren die verantwoordelijk zijn voor de inductie van encystation zijn niet bekend. Encystation begint met de trofozoïeten die meer bolvormig worden en het verschijnen van chromatoïde lichamen in het cytoplasma. Chromatoïde lichamen (cb) zijn gekleurde langwerpige structuren met ronde uiteinden en vertegenwoordigen de aggregatie van ribosomen. De cystewand is samengesteld uit chitine en heeft een glad, refractiel uiterlijk. Cyste rijping omvat twee ronden van nucleaire replicatie zonder celdeling en cysten met 1-4 kernen (Nu) worden gevonden in de ontlasting. De nucleaire morfologie van de cyste is vergelijkbaar met die van de trofozoiet, behalve dat de kernen steeds kleiner worden na elke deling. Soms zijn de jonge cysten (bijv.1-2 kernen) hebben een glycogeen vacuole (vac) die zal verschijnen als een helder gebied in gekleurde monsters. Deze vacuole zal soms de morfologie van de kernen verplaatsen en veranderen. De chromatoïde lichamen hebben de neiging te verdwijnen als de cyste rijpt. De cysten hebben over het algemeen een diameter van 12-15 µm. Cysten zijn onmiddellijk besmettelijk bij uitscheiding met de ontlasting en zullen weken tot maanden levensvatbaar zijn, afhankelijk van de omgevingsomstandigheden.
 |
 |
 |
 |
PATHOGENESE
|
Amebiasis-progressie |
niet-invasief
invasief
|
E. histolytica leeft vaak als commensaal in de dikke darm zonder duidelijke klinische manifestaties. Trofozoïeten kunnen echter het colonepitheel binnendringen en zweren en dysenterie veroorzaken (zie kader). Deze invasieve ziekte kan steeds erger worden en tot een ernstiger ziekte leiden. De amoeben kunnen ook uitzaaien naar andere organen en een extra-intestinale amoebiasis veroorzaken. Met andere woorden, E. histolytica is een facultatieve ziekteverwekker die een breed scala aan virulentie vertoont.
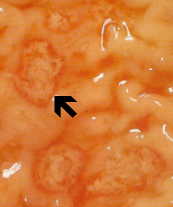
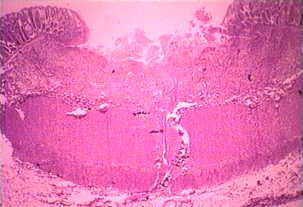
De niet-invasieve ziekte is vaak asymptomatisch, maar kan diarree of andere gastro-intestinale symptomen veroorzaken, zoals buikpijn of krampen. Deze niet-invasieve infectie kan aanhouden of zich ontwikkelen tot een invasieve ziekte waarbij trofozoïeten het darmslijmvlies binnendringen en de epitheelcellen doden. De vroege laesie is een klein gebied met necrose of zweer, gekenmerkt door opstaande randen en vrijwel geen ontsteking tussen laesies (figuur). De ameba verspreidt zich lateraal en naar beneden in de submucosa (onder het epitheel) en doodt gastheercellen naarmate ze vorderen. Dit resulteert in de klassieke ‘flesvormige’ maagzweer met een kleine opening en een brede basis. Trofozoïeten zijn het talrijkst op de grens tussen het gezonde weefsel en het necrotische weefsel.Deze invasieve ameben nemen gastheercellen op en trofozoïeten met ingenomen erytrocyten zijn vaak duidelijk. Deze hematofage trofozoïeten worden soms aangetroffen in de dysenterische ontlasting. De productie van cysten neemt af tijdens het invasieve stadium van de infectie en cysten worden nooit in de weefsellaesies aangetroffen.
 |
 |
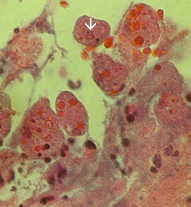 |
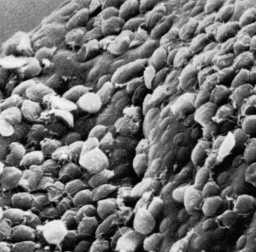
| Links: de lumenale zijde van de karteldarm door een fulminerende amebiasis, met verschillende zweren. Let op opstaande randen (pijl). Midden: histologische voorbereiding met een doorsnede van de zweer. Let op de hoge mate van necrose in het midden van de zweer. De amoeben rukken lateraal op onder het intacte slijmvlies, zoals aangegeven door de microvilli. Rechts: sterkere vergroting van de zweer met verschillende hematofage trofozoïeten. De kern (pijl) is duidelijk in een van de amoeben. Afbeeldingen van Peters en Gilles (1989), A Color Atlas of Tropical Medicine and Parasitology (3e editie). | ||
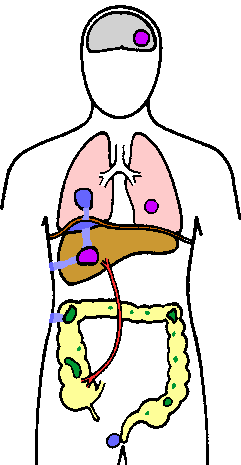 |
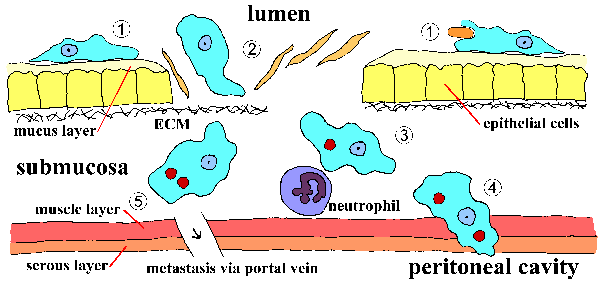
| E. histolytica wordt voornamelijk aangetroffen in de dikke darm, waar het kan leven als een niet-pathogene commensaal of het darmslijmvlies kan binnendringen (groen). De ameba kan via een hematogene route (paars) uitzaaien naar andere organen; voornamelijk met betrekking tot de poortader en lever. De ameba kan zich ook verspreiden via een directe expansie (blauw) waardoor een longinfectie, huidlaesies of perianale ulcera ontstaan. |
Het ulceratieve proces kan zich lateraal of naar beneden blijven uitbreiden. Als er grote aantallen zweren aanwezig zijn, kunnen deze samenvloeien, wat kan leiden tot een plaatselijke afstoting van de darmwand. Zweeruitzetting kan ook de sereuze laag binnendringen en leiden tot perforatie van de darmwand. Deze perforatie kan leiden tot lokale abcessen of een gegeneraliseerde peritonitis. (Zie ook schematische weergave van weefselinvasie .) Amebische ulcera kunnen ook secundair geïnfecteerd raken met bacteriën, wat het klinische beeld kan verwarren. Bovendien E. histolyticainfectie kan soms leiden tot de vorming van een amebisch granuloom, ook wel een ameboom genoemd. Het ameboom is een inflammatoire verdikking van de darmwand rond de zweer die kan worden verward met een tumor.
Amebiasis kan ook evolueren tot een systemische of extraintestinale infectie. Verspreiding van de primaire darmlaesie vindt voornamelijk plaats via de bloedstroom, maar kan ook plaatsvinden door directe uitbreiding van de laesie. De lever is het meest aangetaste orgaan en dit komt waarschijnlijk door het directe transport van trofozoïeten van de dikke darm naar de lever via de hepatische poortader (figuur). Aanvankelijk zijn de laesies kleine necrosehaarden die de neiging hebben om samen te smelten tot een enkel abces als ze uitzetten. Dit leverabces zal zich blijven vergroten naarmate de trofozoïeten geleidelijk gastheercellen vernietigen en opnemen. Het centrum van het abces, bestaande uit gelyseerde hepatocyten, erytrocyten, gal en vet,kan vloeibaar worden en dit necrotische materiaal (soms ten onrechte pus genoemd) zal in kleur variëren van geelachtig tot roodachtig bruin. Secundaire bacteriële infecties in het leverabces komen niet vaak voor (~ 2%).
Hematogene verspreiding van trofozoïeten naar andere plaatsen, zoals de longen of hersenen, is zeldzaam, maar komt wel voor. De tweede meest voorkomende extraintestinale plaats na de lever zijn de longen. Longinfecties zijn meestal het gevolg van een directe uitbreiding van de leverlaesie over het middenrif en naar het borstvlies en de longen. Huidlaesies gevormd als gevolg van lever- of darmfistels kunnen ook voorkomen, hoewel uiterst zeldzaam. Andere huidlaesies zijn onder meer perianale ulcera en betrokkenheid van de genitaliën, inclusief de penis van homoseksuelen. Deze latere manifestaties zijn waarschijnlijk te wijten aan het feit dat de huid of slijmvliezen in contact komen met invasieve trofozoïeten.
 |
 |
 |
 |
MOGELIJKE MECHANISMEN VAN PATHOGENESE
|
Entamoeba- prevalenties |
|
Zoals hierboven besproken , is E. histolytica een ziekteverwekker die een breed spectrum van virulentie vertoont, variërend van een avirulent commensaal tot een zeer invasief en destructief organisme (zie bespreking van pathogeniteit versus virulentie ). Een deel van dit verschil in virulentie wordt verklaard door het bestaan van de morfologisch identieke, maar avirulente E. dispar . E. dispar is nooit in verband gebracht met een symptomatische invasieve ziekte en infectie wekt geen serumantistoffen op. Daarentegen worden humorale reacties tegen ameben waargenomen bij zowel asymptomatische als symptomatische E. histolyticainfecties. Dit suggereert dat zelfs in asymptomatische gevallen er een beperkte mate van invasie is. Een infectie met E. histolytica leidt echter niet altijd tot een invasieve ziekte, aangezien slechts ongeveer 10% van de geïnfecteerde individuen symptomatische invasieve amebiasis zal ontwikkelen. De factoren die verantwoordelijk zijn voor de pathogenese van E. histolytica zijn niet goed begrepen. Een benadering om de pathogenese te begrijpen, is om mogelijke virulentiefactoren tussen deze twee nauw verwante soorten te vergelijken.
gastheer factoren
parasitaire factoren
|
Pathologie is het resultaat van interacties tussen gastheer en parasiet, en daarom kunnen gastheerfactoren, parasitaire factoren of een combinatie van beide bijdragen aan de ziektetoestand. De ontwikkeling van invasieve ziekten kan bijvoorbeeld het gevolg zijn van kwantitatieve of kwalitatieve aspecten van de immuunrespons van de gastheer. Rekrutering van neutrofielen en intense ontstekingen worden opgemerkt in de vroege fasen van de invasie van ameben. De ontsteking rond gevestigde zweren en abcessen is echter vaak minimaal gezien de mate van weefselschade.
De aard van beschermende immuunresponsen is niet duidelijk. Zowel aangeboren of niet-specifieke immuniteit als verworven immuniteit zijn waarschijnlijk beide belangrijk voor de preventie van invasieve ziekten. De slijmlaag die de epitheiliale cellen bedekt, kan contact tussen trofozoiet en gastheercellen voorkomen. Bovendien treden mucosale IgA-responsen op als gevolg van infectie en fecaal IgA tegen een trofozoïet oppervlaktelectine ( zie Eh-lectine ) zijn geassocieerd met een lagere incidentie van nieuwe E. histolyticainfecties. Hoge titers van serumantistoffen ontwikkelen zich ook bij patiënten met leverabcessen. Aangezien de invasieve ziekte echter vaak progressief en niet-remmend is, is de rol van deze anti-ameba-antilichamen in het geding. Celgemedieerde reacties lijken een rol te spelen bij het beperken van de omvang van invasieve amebiasis en het beschermen van de gastheer tegen herhaling na succesvolle behandeling.
Weerstand tegen de immuunrespons van de gastheer is een andere mogelijke virulentiefactor die zou kunnen bijdragen aan de ontwikkeling en verergering van invasieve ziekten. Een fenotypisch verschil tussen E. dispar en E. histolytica is bijvoorbeeld de resistentie van de laatste om gemedieerde lysis aan te vullen ( zie E. dispar ). Bovendien breekt E. histolytica snel secretoire IgA af en onderdrukt mogelijk T-celreacties op E. histolytica- antigenen. E. histolyticais ook in staat om cellen, waaronder neutrofielen en andere immuuneffectorcellen, op een contactafhankelijke manier te doden. Lysis van neutrofielen kan ook giftige producten vrijgeven die bijdragen aan de vernietiging van gastheerweefsel. De rol van deze verschillende verschijnselen bij pathogenese is echter niet bekend.
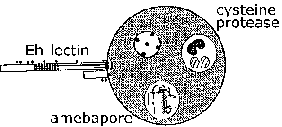
Invasie van darmslijmvlies door E. histolytica is een actief proces gemedieerd door de parasiet en verschillende stappen kunnen worden herkend (Figuur, klik hier voor grotere afbeeldingen gedetailleerde legende). Trofozoïeten hechten zich aan de slijmlaag (stap 1). Deze hechting op zich draagt waarschijnlijk niet bij aan pathogenese en is gewoon een mechanisme voor de amoebe om langs het substraat te kruipen. Door uitputting van de slijmbarrière kan het trofozoiet in contact komen met epitheelcellen. Epitheelcellen worden op een contactafhankelijke manier gedood, wat leidt tot een verstoring van het darmslijmvlies (stap 2). De trofozoïeten zullen gastheercellen in de submucosa blijven doden en het weefsel verder verstoren naarmate ze verder gaan (stap 3). Verstoring van de darmwand (stap 4) of uitzaaiing via de bloedsomloop (stap 5) is ook mogelijk. Therapietrouw, cytotoxiciteit en verstoring van de weefsels zijn belangrijke factoren bij de pathogenese van E. histolytica. Parasieteiwitten die bij deze processen een rol kunnen spelen, zijn onder meer: het Eh-lectine , amebapore en proteasen .
Eh-lectin. E. histolytica kan cellen doden binnen enkele minuten nadat ze eraan zijn gehecht in aanwezigheid van extracellulair calcium. Aanhankelijkheid van E. histolyticatrofozoïeten voor gastheercellen en mucines van het colon wordt gemedieerd door een lectine-activiteit die tot expressie wordt gebracht op het oppervlak van de ameba. Dit lectine bindt galactose of N-acetyl-D-galactosamine (GalNAc) met een hoge affiniteit en wordt ook wel het galactose-inhibitable-adherence protein (GIAP) of het Gal / GalNAc-lectine genoemd. Het contactafhankelijk doden van doelwitcellen wordt bijna volledig geremd door galactose of GalNAc en doelwitcellen zonder terminale galactoseresiduen op hun oppervlakteglycoproteïnen zijn resistent tegen aanhechting van trofozoïeten en cytotoxiciteit. Dit suggereert dat het Gal / GalNAc-lectine een belangrijke virulentiefactor is. Bovendien is het Eh-lectine betrokken bij resistentie tegen complement-gemedieerde lysis. Vanwege zijn potentiële rol bij therapietrouw en virulentie en omdat fecaal IgA ertegen beschermt tegen amebische colitis,de Gal / GalNAc is een kandidaat-vaccin (Petri et al, 2006,Boog. Med. Res. 37: 288 ).
Het Eh-lectine is een heterodimeer dat bestaat uit een zware keten van 170 kDa en een lichte keten van 31-35 kDa verbonden door disulfidebindingen. Een tussenliggende subeenheid van 150 kDa is niet-covalent geassocieerd met het heterodimeer. De zware keten heeft een transmembraandomein en een koolhydraatbindend domein. Alle subeenheden worden gecodeerd door multigenfamilies. Er zijn vijf leden van de familie van zware ketens, 6-7 leden van de familie van lichte ketens en 30 leden van de familie van tussenliggende ketens. De leden van de genfamilie van de zware keten vertonen 89-95% sequentie-identiteit op het aminozuurniveau, terwijl de leden van de lichte keten minder geconserveerd zijn en slechts 79-85% sequentie-identiteit delen.
E. dispar brengt ook Gal / GalNAc-lectine op zijn oppervlak tot expressie. Zowel E. dispar als E. histolytica moeten zich hechten aan de slijmlaag die wordt behandeld door het Gal / GalNAc-lectine. Mucus is samengesteld uit glycoproteïnen die mucines worden genoemd. Het overheersende mucine dat op het darmslijmvlies wordt aangetroffen, is Muc2, dat uitgebreid is geglycosyleerd met O-gekoppelde GalNAc-residuen. De sequentie van de genen van de lichte en zware keten van E. dispar is homoloog, maar niet identiek, aan die van E. histolytica . Antigene verschillen tussen de GIAP van E. dispar en E. histolytica zijn ook beschreven doordat slechts twee van de zes epitopen worden gedeeld tussen de twee soorten (zie E. dispar ). Het is niet bekend of deze sequentieverschillen de verschillen in virulentie tussen E. dispar en E. histolytica kunnen verklaren . Adherentie is uiteraard belangrijk voor beide soorten, maar het is mogelijk dat de therapietrouw kwalitatief of kwantitatief verschilt tussen de twee soorten.
[Recensie over de Eh-lectine: Petri et al (2002) Annu. Rev. Microbiol. 56:39 .]
Amebapore. Een familie van porievormende polypeptiden is geïdentificeerd in E. histolytica en E. dispar . De drie familieleden worden aangeduid als amebapore A, B en C, waarbij amebapore A overheersend wordt uitgedrukt. Het volwassen polypeptide is 77 aminozuren lang en vormt dimeren bij lage pH (4-6). Drie van deze dimeren worden vervolgens samengevoegd tot een holle ringvormige structuur. Dit hexameer kan vervolgens in membranen intercaleren en poriën van 2 nm (dwz gaten) introduceren, wat resulteert in celdood. De porievormende activiteit is afhankelijk van dit assemblageproces dat begint met de dimerisatie. Amebabpore A is 95% identiek (dwz vier residuen zijn verschillend) tussen E. histolytica en E. dispar . tevens deE. dispar amebapore heeft ongeveer de helft van de poriënvormende activiteit als E. histolytica amebapore. Dit verschil in porievormende activiteit wordt toegeschreven aan een glutamaatresidu op positie 2 in de E. histolytica amebapore, vergeleken met een prolineresidu in de E. dispar amebapore. Dit specifieke aminozuurresidu is belangrijk voor de vorming van de dimeren en er wordt aangenomen dat de dimeren van E. dispar amebapore minder stabiel zijn.
Amebapore is gelokaliseerd in vacuolaire compartimenten (bijv. Voedselvacuolen) binnen het trofozoiet en is het meest actief bij een zure pH, wat suggereert dat de belangrijkste functie van amebapore het lyseren van ingenomen bacteriën is. Desalniettemin wordt amebapore als een virulentiefactor geïmpliceerd doordat genetische manipulatie van E. histolytica, resulterend in verminderde expressie van amebapore, leidt tot een vermindering van de pathogeniteit (het vermogen om leverabcessen te vormen) evenals een vermindering van de bacteriocidale activiteit (Bracha et al Mol. Microbiol. 34: 363 , 1999). Evenzo zijn gemodificeerde E. histolytica die volledig verstoken zijn van amebapore-productie niet in staat om leverabcessen te vormen in modelsystemen (Zhang et al, Inf. Imm. 72: 678, 2004). Deze ameben kunnen echter ontstekingen en weefselschade veroorzaken in modellen voor amebische colitis.
[Recensie over amebapore: Leippe et al, Tr. Parasitol. 21: 5 , 2005.]
Proteasen. Proteasen zijn enzymen die andere eiwitten afbreken en kunnen bijdragen aan de pathogenese veroorzaakt door E. histolytica . In dit opzicht brengt E. histolytica hogere niveaus van cysteïneproteasen tot expressie en scheidt deze af, een bepaalde klasse van proteasen, dan E. dispar . Van cysteïneproteasen is aangetoond dat ze de polymerisatie van MUC2, de belangrijkste component van darmslijm, verstoren. Dit afgebroken slijm is minder efficiënt in het blokkeren van de hechting van trofozoïeten aan epitheelcellen. Vernietiging van de extracellulaire matrix (ECM) door proteasen kan ook de invasie van trofozoïeten vergemakkelijken. Remmers van cysteïneproteasen kunnen de grootte van het leverabces in experimentele modellen verkleinen.
|
|
|
| Factor | histolytica vs dispar |
| Eh-lectin | sequentie en epitoopverschillen |
| amebapore | Ed heeft minder activiteit (Pro / Glu) |
| proteasen | Eh heeft unieke genen en drukt meer activiteit uit |
| Figuur uit Horstmann et al (1992) Trop. Med. Parasitol. 43, 213. | |
Twintig verschillende cysteïneproteasegenen zijn geïdentificeerd in E. histolytica . Orthologen van twee van de E. histolytica cysteïne protease-genen worden niet gevonden in E. dispar . Een van deze, aangeduid als CP5, komt tot uiting op hoge niveaus op het trofozoietoppervlak. Mutanten die lagere CP5-niveaus tot expressie brengen, hadden een verminderd vermogen om leverabcessen te genereren in een hamsteramebiasismodel. Deze mutanten hadden echter ook een verminderde groeisnelheid en een lagere erythrofagocytische activiteit, dus het is niet duidelijk of CP5 rechtstreeks deelneemt aan de invasiviteit van E. histolytica . Bovendien had remming van 90% van CP5-activiteit geen invloed op het vermogen van E. histolyticatrofozoïeten om celmonolagen in vitro te vernietigen. CP1, CP2 en CP5 zijn de meest voorkomende cysteïneproteasen in E. histolytica , terwijl CP3 het meest voorkomt in E. dispar. Interessant genoeg verhoogde overexpressie van CP2 in E. dispar het vermogen van trofozoïeten om celmonolagen in vitro te vernietigen. De overexpressie van CP2 leidde echter niet tot het vermogen van E. dispar om leverabcessen te vormen bij gerbils. Daarom is het niet duidelijk welke precieze rol proteasen kunnen spelen bij pathogenese.
Samenvattend is de pathogenese geassocieerd met E. histolytica- infectie voornamelijk te wijten aan het vermogen om weefsels binnen te dringen en gastheercellen te doden. Er zijn verschillende potentiële virulentiefactoren geïdentificeerd (zie tabel). Het is echter niet duidelijk welke exacte rol deze verschillende virulentiefactoren spelen bij de ontwikkeling van invasieve ziekten. Een benadering om de pathogenese te begrijpen, is door deze factoren van E. histolytica en E. dispar te vergelijken. Deze twee soorten zijn nauw verwant en de potentiële virulentiefactoren worden in beide soorten aangetroffen. Therapietrouw, cytolytische activiteit en proteolytische activiteit zijn inherente biologische kenmerken van beide soorten en deze activiteiten leiden niet noodzakelijk tot pathologie. Er zijn echter kwalitatieve en kwantitatieve verschillen tussen E. histolytica en E. dispar die de verschillen in virulentie kunnen verklaren. Deze genetische verschillen tussen E. histolytica en E. dispargeven aan dat pathogenese gedeeltelijk een inherent kenmerk is van de parasiet. Pathogenese is echter waarschijnlijk te wijten aan de gecombineerde effecten van verschillende gastheer- en parasietfactoren, en de virulentie kan de mate vertegenwoordigen waarin de gastheer de invasie en replicatie van trofozoïeten kan beheersen.
[Zie Huston, 2004, Tr. Parasitol. 20:23 of Ralston en Petri, 2011, Tr. Parasitol. 27: 253 voor recensies over pathogenese.]
 |
 |
 |
 |
KLINISCHE PRESENTATIE
Amebiasis vertoont een breed scala aan klinische syndromen (tabel) die de mogelijkheid weerspiegelen dat E. histolytica invasief wordt en een progressieve ziekte veroorzaakt . De incubatietijd kan variëren van een paar dagen tot maanden of jaren, waarbij 2-4 weken de meest voorkomende zijn. Overgangen van het ene type darmsyndroom naar het andere kunnen optreden en darminfecties kunnen aanleiding geven tot extraintestinale infecties.
Intestinale ziekte
Extraintestinale ziekte
|
De meerderheid van de mensen bij wie E. histolytica (of E. dispar ) is vastgesteld, vertonen geen symptomen of hebben vage en niet-specifieke buikklachten. Deze toestand kan aanhouden of zich ontwikkelen tot een symptomatische infectie. Symptomatische niet-dysenterische infecties vertonen variabele symptomen, variërend van mild en voorbijgaand tot intens en langdurig. Typische symptomen zijn onder meer: diarree, krampen, winderigheid, misselijkheid en anorexia. De diarree wordt vaak afgewisseld met perioden van constipatie of zachte ontlasting. Ontlasting bevat soms slijm, maar er is geen zichtbaar bloed.
Amebische dysenterie begint gewoonlijk langzaam gedurende een aantal dagen met buikkrampen, tenesmus en soms dunne ontlasting, maar ontwikkelt zich tot diarree met bloed en slijm. Bloed, slijm en stukjes necrotisch weefsel worden duidelijker naarmate het aantal ontlasting toeneemt (10-20 of meer per dag) en ontlasting bevat vaak weinig ontlasting. Enkele patiënten kunnen koorts, braken, gevoelige buik of uitdroging krijgen (vooral kinderen) naarmate de ernst van de ziekte toeneemt. Fulminante of grangreneuze colitus is een zeldzame maar uiterst ernstige vorm van intestinale amebiasis. Patiënten vertonen ernstige bloederige diarree, koorts en diffuse buikgevoeligheid. Het grootste deel van het slijmvlies is erbij betrokken en de mortaliteit bedraagt meer dan 50%. Een chronische amebiasis,gekenmerkt door terugkerende aanvallen van dysenterie met tussenliggende perioden van milde of matige gastro-intestinale symptomen, kunnen ook voorkomen.
Amebomen presenteren zich als pijnlijke buikmassa’s die het vaakst voorkomen in de blindedarm en de stijgende dikke darm. Obstructieve symptomen of bloedingen kunnen ook verband houden met een ameboom. Amebomen komen niet vaak voor en kunnen worden verward met carcinomen of tumoren. Perianale ulcera zijn een vorm van huidamebiasis die het gevolg is van de directe verspreiding van de darminfectie.
Amebische leverabcessen zijn de meest voorkomende vorm van extraintestinale amebiasis. Hepatische symptomen kunnen snel of geleidelijk optreden. Hepatische infecties worden gekenmerkt door hepatomegalie, gevoelige lever, pijn in het kwadrant rechtsboven, koorts en anorexia. Koorts komt soms dagelijks in de middag of avond voor. Leverfunctietesten zijn meestal normaal of licht abnormaal en geelzucht is ongebruikelijk. Leverabcessen zullen af en toe in het peritoneum scheuren, wat resulteert in peritonitis.
Pulmonale amebiasis is meestal het gevolg van de directe uitbreiding van het leverabces door het middenrif. Klinische symptomen zijn meestal hoesten, pijn op de borst, kortademigheid (moeilijke ademhaling) en koorts. Het sputum kan etterig of met bloed gekleurd zijn en trofozoïeten bevatten. Een overvloedige slijmopneming (dwz braaksel) van etterend materiaal kan ook voorkomen. Primaire metastase naar de longen is zeldzaam, maar komt wel voor. Evenzo is infectie van andere organen (bijv. Hersenen, milt, hartzakje) ook zeldzaam. Klinische symptomen houden verband met het aangetaste orgaan.
Cutane amebiasis is het resultaat van het baden van huid of slijmvliezen in vloeistoffen die trofozoïeten bevatten. Dit contact kan het gevolg zijn van een fistel (intestinaal, lever, perineaal) of een invasie van de geslachtsorganen. Huidlaesies hebben een nat, korrelig, necrotisch oppervlak met prominente randen en kunnen zeer destructief zijn. Klinische diagnose is moeilijk en wordt meestal overwogen met epidemiologische risicofactoren (bijv. Endemische gebieden, mannelijke homoseksualiteit, enz.).
 |
 |
 |
 |
DIAGNOSE, BEHANDELING EN CONTROLE
|
Diagnose |
Intestinale ziekte
Extraintestinale (lever) ziekte
|
Definitieve diagnose van amebiasis vereist het aantonen van E. histolytica cysten of trofozoïeten in ontlasting of weefsels. Ontlastingsmonsters moeten worden bewaard en gekleurd en microscopisch onderzocht. Cysten hebben de neiging om te overheersen in gevormde ontlasting en trofozoïeten in diarree-ontlasting ( zie morfologie ). Verse ontlasting kan ook onmiddellijk worden onderzocht op beweeglijke trofozoïeten die een progressieve beweeglijkheid vertonen. Sigmoidoscopie kan de karakteristieke zweren onthullen, vooral bij ernstigere ziekten. Aspiraten of biopsieën moeten ook microscopisch worden onderzocht op trofozoïeten.
E. histolytica en E. dispar kunnen niet op morfologische criteria worden onderscheiden. Er zijn antigeendetectiekits beschikbaar voor de positieve identificatie van deze soorten. Een dergelijke snelle antigeendetectietest is de E. HISTOLYTICA QUIK CHEK (TechLab, Inc).
Serologie is vooral nuttig voor de diagnose van extraintestinale amebiasis. Meer dan 90% van de patiënten met invasieve colitis en leverabcessen vertonen serumantistoffen tegen E. histolytica. De antilichamen kunnen echter jarenlang aanhouden en het onderscheiden van vroegere en huidige infecties kan problemen opleveren in endemische gebieden. Niet-invasieve beeldvormende technieken (bijv. Echografie, CT, MRI) kunnen worden gebruikt om leverabcessen op te sporen. Het is ook mogelijk om hepatische abcessen op te zuigen. Dit wordt echter zelden gedaan en alleen in geselecteerde gevallen geïndiceerd (bijv. Serologie en beeldvorming niet beschikbaar, therapeutische doeleinden). Het aspiraat is meestal een dikke roodbruine vloeistof die zelden trofozoïeten bevat. Trofozoïeten zijn het meest waarschijnlijk te vinden aan de abceswand en niet in het necrotische afval in het abcescentrum.
Er zijn verschillende medicijnen beschikbaar voor de behandeling van amebiasis en de keuze van medicijn (en) hangt af van het klinische stadium van de infectie (tabel). De prognose na behandeling is over het algemeen goed in ongecompliceerde gevallen. In gevallen waarin E. histolyticais bevestigd of de soort (dwz dispar of histolytica) onbekend is, moeten asymptomatische cystenpassagiers worden behandeld om de progressie naar een ernstige ziekte te voorkomen en de verspreiding van de ziekte onder controle te houden. In veel endemische gebieden, waar de herinfectiepercentages hoog zijn en de behandeling duur is, is het de standaardpraktijk om alleen symptomatische gevallen te behandelen. Metronidazol of tinidazol (indien beschikbaar) wordt aanbevolen voor alle symptomatische infecties. Deze behandeling moet worden gevolgd door of gecombineerd met lumenale antiamebica, zoals beschreven voor asymptomatische patiënten.
Amebiasis-behandeling |
||||||||
|
In het geval van fulminante amemische colitis of perforatie van de darmwand kan ook een breedspectrum antibioticum worden gebruikt om darmbacteriën in het peritoneum te behandelen. Necrotische colitis vereist een dringende ziekenhuisopname om de vocht- en elektrolytenbalans te herstellen. Bovendien worden emetine of dehydroemetine soms gelijktijdig toegediend met nitroimidazol. Dit gebeurt alleen in de meest ernstige gevallen vanwege de toxiciteit van deze medicijnen. Een operatie kan ook nodig zijn om perforaties of een gedeeltelijke colostoma te sluiten. Abcesdrainage van leverlaesies (dwz naaldaspiratie of chirurgische drainage) wordt nu zelden voor therapeutische doeleinden uitgevoerd en is alleen geïndiceerd in gevallen van grote abcessen met een grote kans op ruptuur.
Preventie- en controlemaatregelen zijn vergelijkbaar met andere ziekten die worden overgedragen via de fecaal-orale route (zie Risicofactoren of bespreking van Giardia- controle ). Het grote verschil is dat de mens de enige gastheer is voor E. histolytica en dat er geen kans is op zoönotische overdracht. Controle is gebaseerd op het vermijden van besmetting van voedsel of water met fecaal materiaal. Gezondheidsvoorlichting met betrekking tot het verbeteren van persoonlijke hygiëne, hygiënische verwijdering van uitwerpselen en handen wassen zijn bijzonder effectief. Door de watervoorraden te beschermen, worden endemieën en epidemieën verminderd. Net als Giardia , Entamoebacysten zijn resistent tegen standaard chloorbehandeling, maar worden gedood door jodium of koken. Sedimentatie- en filtratieprocessen zijn behoorlijk effectief bij het verwijderen van Entamoeba- cysten. Chemoprofylaxe wordt niet aanbevolen.
Beoordelingen over amebiasis:
- Haque, R. et al. (2003) Amebiasis. N. Engl. J. Med. 348: 1565 .
- Stanley, SL (2003) Amoebiasis. The Lancet 361: 1025 .
BLASTOCYSTIS HOMINIS
Blastocystis hominis is een veel voorkomend organisme dat wordt aangetroffen in menselijke ontlasting. Sinds de eerste beschrijving ongeveer 100 jaar geleden, is het op verschillende manieren geclassificeerd als een ameba, een gist, een sporozoa en het cyste stadium van een flagellaat. Analyse van de kleine subeenheid-rRNA-sequentie geeft aan dat Blastocystis het nauwst verwant is aan de stramenopiles, een complexe verzameling van eencellige en muticellulaire protisten. Andere stramenopiles zijn diatomeeën, bruine algen en watervormen. Veel van de kenmerken van Blastocystis zijn onbekend of controversieel. De wijze van overdracht, het mechanisme van celreplicatie en andere kenmerken van de levenscyclus zijn niet afdoende aangetoond. Evenzo de status van Blastocystis als pathogeen, commensaal of opportunistisch organisme is onbekend.
Blastocystis is polymorf doordat een verscheidenheid aan morfologische vormen wordt aangetroffen in ontlasting en in vitro kweek. De meest algemeen erkende vorm is bolvormig met een diameter van 10-15 µm met een grote centrale vacuole (figuur). Deze grote vacuole duwt de kernen en andere organellen naar de periferie van de cel. De vacuole is soms gevuld met een korrelig materiaal. Kleine resistente cyste-achtige vormen zijn geïdentificeerd uit in vitro culturen en worden af en toe waargenomen in de ontlasting. Deze veronderstelde cysten zijn ongeveer 5 µm en omgeven door een meerlaagse wand. Bovendien lyseren de cysten niet wanneer ze in water worden geplaatst, wat suggereert dat ze bestand zijn tegen omgevingsomstandigheden. Vermoedelijk Blastocystiswordt overgedragen via een fecaal-orale route. Dit is echter niet afdoende aangetoond.
Er zijn verschillende rapporten die suggereren dat Blastocystis ziekte veroorzaakt, evenals veel rapporten die het tegenovergestelde suggereren. Diarree, krampen, misselijkheid, braken en buikpijn zijn in verband gebracht met een groot aantal organismen in de ontlasting. Bovendien hebben sommige onderzoeken aangetoond dat behandeling de symptomen verlicht en de organismen zuivert. De medicijnen die tegen blastocystis worden gebruikt (bijv. Metronidazol), werken echter ook tegen veel andere darmprotozoa en bacteriën. Het onvermogen om andere organismen als bron van symptomen uit te sluiten en de observatie dat veel geïnfecteerde personen geen symptomen vertonen, maakt het moeilijk om definitieve conclusies te trekken over de pathogenese van Blastocystis . Bovendien kan het dat zijnBlastocystis is in de eerste plaats een commensaal, maar kan virulentie vertonen onder specifieke gastheeromstandigheden zoals gelijktijdige infecties, slechte voeding of immunosuppressie.
Blastocystis wordt ook aangetroffen in een breed scala aan dieren, waaronder zoogdieren, vogels, reptielen, amfibieën en zelfs insecten, en vertoont een breed scala aan moleculaire diversiteit. De genetische afstand tussen Blastocystis- isolaten is groter dan de genetische afstand tussen E. histolytica en E. dispar ( zie discussie over E. dispar ). Dit bemoeilijkt de aanwijzing van soorten en historisch menselijke isolaten werden aangeduid als B. hominis en isolaten voor andere gastheren als Blastocytis.sp .. Fylogenetische analyse onthult echter dat er geen uitsluitend menselijke clades zijn en menselijke isolaten worden in alle clades aangetroffen. Dit verhoogt de mogelijkheid dat Blastocystis niet gastheerspecifiek is en zoönotisch kan worden overgedragen. Bovendien zou het brede scala aan genetische diversiteit de controverse over de pathogeniteit van Blastocystis kunnen verklaren doordat sommige genotypen virulenter kunnen zijn dan andere. Studies die dit probleem aanpakken, suggereren echter dat dit niet het geval is. Om de verwarring over de taxonomie, transmissie en virulentie van blastocystis op te lossen, is aanvullend onderzoek nodig.
Beoordelingen over Blastocystis :
- Clark CG, van der Giezen M, Alfellani MA, Stensvold CR (2013) Recente ontwikkelingen in blastocystisonderzoek . Vooruitgang in parasitologie 82, 1-32 .
- Scanlan PD (2012) Blastocystis : valkuilen uit het verleden en toekomstperspectieven. Trends in parasitologie 28, 327-334 .
- Tan KSW, Mirza H, Teo JDW, Wu B, MacAry PA (2010) Huidige opvattingen over de klinische relevantie van Blastocystis spp. Huidige rapporten over infectieziekten 12, 28-35 .
 |
 |
 |
 |
NIET-PATHOGENE COMMENSALS
Talrijke protozoa kunnen het maagdarmkanaal van mensen bewonen. De meeste hiervan vertonen weinig of geen openlijke pathologie. Infectie met deze protozoa is een bewijs van fecale besmetting en duidt op een risico op ernstigere infecties zoals Giardia of E. histolytica . Deze niet-pathogene soorten kunnen ook worden verward met de potentieel pathogene Giardia of E. histolytica en resulteren in onnodige medicamenteuze behandeling. Bovendien is een dergelijke verkeerde diagnose ook problematisch omdat de ware oorzaak van de symptomen kan worden gemist en de juiste behandeling zal worden uitgesteld.
|
- Andere Entamoeba
- Andere intestinale Amebae
- Andere intestinale flagellaten
- Blastocystis
Entamoeba- soorten die mensen infecteren
Verschillende Entamoeba- soorten infecteren mensen (doos). E. histolytica kan een ernstige darmziekte veroorzaken die wordt gekenmerkt door dysenterie, evenals een invasieve ziekte die voornamelijk de lever treft (zie Amebiasis ). E. dispar is morfologisch identiek aan E. histolytica , maar veroorzaakt geen invasieve ziekte (zie de verdere bespreking van E. dispar ). Een onderscheidend kenmerk van de Entamoeba is hun nucleaire morfologie die wordt beschreven met perifere chromatine en een klein karyosoom. E. histolytica / dispar , E. coli en E. hartmanni kunnen worden onderscheiden door grootte en kleine morfologische verschillen (zie tabel).
| Intestinale Entamoeba- soorten | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
* = E. histolytica ; ** invasieve E. histolytica kan> 20 mm groot zijn |
E. coli is de grootste en wordt het best onderscheiden door 8 kernen in de volwassen cyste. De trofozoïeten van E. coli kunnen moeilijk te onderscheiden zijn van E. histolytica / dispar aangezien er enige overlap is in de groottebereiken. E. hartmanni lijkt veel op E. histolytica en werd voorheen beschouwd als een ‘klein ras’ van E. histolytica . In het algemeen wordt 10 µm gekozen als grens tussen E. histolytica en E. hartmanni .
E. polecki wordt meestal geassocieerd met varkens en apen, maar er zijn af en toe gevallen bij de mens gedocumenteerd. Het lijkt geografisch beperkt te zijn tot bepaalde gebieden zoals Papoea, Nieuw-Guinea. De trofozoïeten zijn vergelijkbaar met E. coli , behalve een beetje kleiner, en de cysten zijn vergelijkbaar met E. histolytica behalve dat de volwassen cyste een enkele kern heeft.
E. gingivalis kan worden hersteld van het zachte tandsteen tussen de tanden en vertoont een vergelijkbare morfologie als E. histolytica, behalve dat het geen cyste stadium heeft. E. gingivalis kan zich ook vermenigvuldigen in bronchiaal slijm en kan dus in het sputum verschijnen. In dit geval kan het worden verward met E. histolytica van een longabces. E. gingivalis trofozoïeten bevatten vaak opgenomen leukocyten die kunnen worden gebruikt om het te onderscheiden van E. histolytica . De trofozoïeten worden meestal hersteld bij patiënten met parodontitis, maar een etiologie tussen het organisme en de ziekte is niet vastgesteld en E. gingivalis wordt als niet-pathogeen beschouwd.
Andere intestinale Amebae
Andere niet-pathogene ameben zijn onder andere Endolimax nana en Iodoamoeba bütschlii . Historisch gezien is Dientamoeba fragilis gegroepeerd met de ameba, maar elektronenmicroscopie en moleculaire fylogenetica suggereren dat het eigenlijk een flagellaat is en mogelijk nauw verwant is aan de trichomonaden (zie hierboven). Alle drie deze organismen vertonen vergelijkbare morfologieën en hebben kernen die geen perifeer chromatine en een groot karyosoom hebben. Door kleine morfologische verschillen kunnen deze organims worden onderscheiden (tabel).
| Andere intestinale Amebae | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
* Een flagellaat mogelijk gerelateerd aan de trichomonaden. |
Andere intestinale flagellaten
Vier andere niet-pathogene flagellaten die uit menselijke ontlasting worden gewonnen, zijn: Trichomonas hominis , Chilomastix mesnili , Enteromonas hominis en Retortamonas intestinalis . Onder deze T. hominis , ook wel Pentatrichomonas hominis genoemd , komt het meest voor en wordt vaak hersteld van diarree-ontlasting. Deze flagellaten vertonen vergelijkbare morfologieën (tabel) en kunnen moeilijk te onderscheiden zijn. De trofozoïeten van al deze flagellaten zijn enigszins traanvormig en bevatten een enkele kern en de cyste is meestal enigszins langwerpig of ovaal.
| Andere intestinale flagellaten | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||||||||||