Esta página describe las teorías de ácidos y bases de Arrhenius, Bronsted-Lowry y Lewis, y explica las relaciones entre ellas. También explica el concepto de un par conjugado: un ácido y su base conjugada, o una base y su ácido conjugado.
La teoría de Arrhenius de ácidos y bases
La teoría
- Los ácidos son sustancias que producen iones de hidrógeno en solución.
- Las bases son sustancias que producen iones de hidróxido en solución.
La neutralización ocurre porque los iones de hidrógeno y los iones de hidróxido reaccionan para producir agua.
![]()
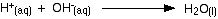
Limitaciones de la teoría
El ácido clorhídrico es neutralizado por la solución de hidróxido de sodio y la solución de amoníaco. En ambos casos, obtienes una solución incolora que puedes cristalizar para obtener una sal blanca, ya sea cloruro de sodio o cloruro de amonio.
Estas son claramente reacciones muy similares. Las ecuaciones completas son:
![]()
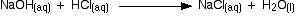
![]()
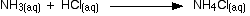
En el caso del hidróxido de sodio, los iones de hidrógeno del ácido reaccionan con los iones de hidróxido del hidróxido de sodio, en línea con la teoría de Arrhenius.
Sin embargo, en el caso del amoniaco, ¡no parece haber ningún ion de hidróxido!
Pero si observa cuidadosamente las ecuaciones, el amoníaco está en solución: NH3 (aq). El amoníaco reacciona con agua así:
![]()
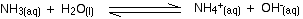
Esta es una reacción reversible, y en una solución típica de amoníaco diluido, aproximadamente el 99% del amoníaco permanece como moléculas de amoníaco. Sin embargo, hay iones de hidróxido y reaccionan con iones de hidrógeno exactamente de la misma manera que los iones de hidróxido de hidróxido de sodio.
De modo que puede justificar que el amoniaco es una base en la definición de Arrhenius: produce iones de hidróxido en solución. Pero la mayor parte de la reacción va a ser una reacción directa entre las moléculas de amoníaco y los iones de hidrógeno, lo que no se ajusta a la definición de Arrhenius.
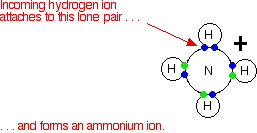
Esta misma reacción también ocurre entre el gas amoníaco y el gas cloruro de hidrógeno.
![]()
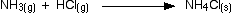
En este caso, no hay iones de hidrógeno o iones de hidróxido en solución, porque no hay solución. La teoría de Arrhenius no consideraría esto como una reacción ácido-base, a pesar de que está produciendo el mismo producto que cuando las dos sustancias estaban en solución. ¡Eso es tonto!
La teoría de Bronsted-Lowry de ácidos y bases
La teoría
- Un ácido es un donador de protones (iones de hidrógeno).
- Una base es un aceptor de protones (iones de hidrógeno).
La relación entre la teoría de Bronsted-Lowry y la teoría de Arrhenius
La teoría de Bronsted-Lowry no va en contra de la teoría de Arrhenius de ninguna manera, simplemente se agrega.
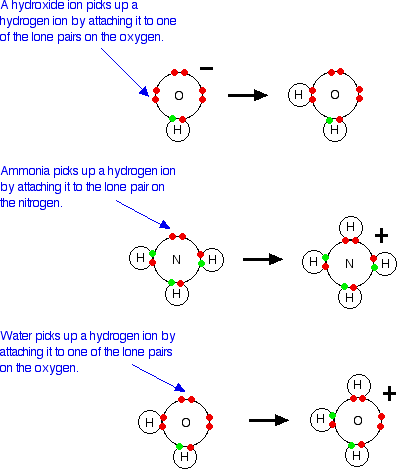
Los iones hidróxido son todavía bases porque aceptan iones de hidrógeno de ácidos y forman agua.
Un ácido produce iones de hidrógeno en solución porque reacciona con las moléculas de agua dándoles un protón.
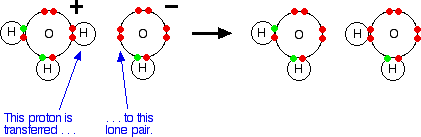
Cuando el gas de cloruro de hidrógeno se disuelve en agua para producir ácido clorhídrico, la molécula de cloruro de hidrógeno da un protón (un ion de hidrógeno) a una molécula de agua. Un enlace coordinado (dativo covalente) se forma entre uno de los pares solitarios en el oxígeno y el hidrógeno del HCl. Se producen iones hidroxonio, H3O +.
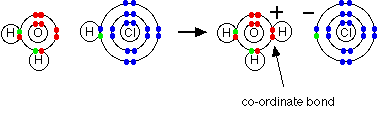
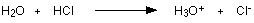
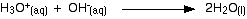
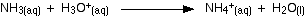
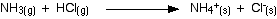
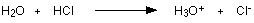
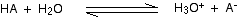
-
El HA es un ácido porque dona un protón (ion de hidrógeno) al agua.
-
El agua es una base porque acepta un protón del HA.
-
El H3O + es un ácido porque está donando un protón (ion de hidrógeno) al ion A.
-
El ion A es una base porque acepta un protón del H3O +.
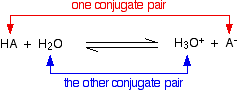

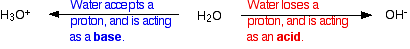
-
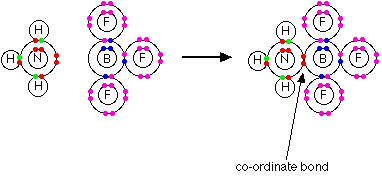
Un ácido es un aceptor de pares de electrones.
-
Una base es un donador de pares de electrones.
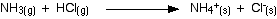

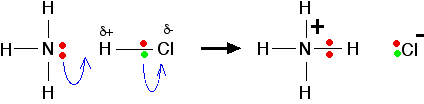
-
Un ácido de Lewis es un aceptor de pares de electrones.
-
Una base de Lewis es un donador de pares de electrones.
